
 酱油是一种常用调味剂,根据国标要求酱油中NaCl的含量不应低于15g/100mL.莫尔法是较简单的一种测量Cl-含量的方法.现采用该法测量某市售酱油是否符合NaCl含量标准要求.实验原理如下(25℃):Ag++Cl-=AgCl (白色)Ksp(AgCl)=1.8×l0-10
酱油是一种常用调味剂,根据国标要求酱油中NaCl的含量不应低于15g/100mL.莫尔法是较简单的一种测量Cl-含量的方法.现采用该法测量某市售酱油是否符合NaCl含量标准要求.实验原理如下(25℃):Ag++Cl-=AgCl (白色)Ksp(AgCl)=1.8×l0-10分析 (1)根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(2)硝酸银见光易分解,要避光;滴定操作中,眼睛应该注视着锥形瓶中溶液的颜色变化;根据滴定原理:氯离子首先与银离子反应,然后重铬酸根离子与银离子反应解答;
(3)根据滴定管的结构和精确度以及测量的原理;
(4)根据Ag++Cl-═AgCl来计算稀释后的酱油中NaCl的浓度;根据稀释时溶质的物质的量不变求出原酱油中NaCl浓度,从而计算出NaCl含量,以判断是否合格.
解答 解:(1)样品稀释过程中,用酸式滴定管或移液管移取酱油样品,应在100 mL容量瓶中定容,还需用到的玻璃仪器有烧杯、玻璃棒、胶头滴管;
故答案为:酸式滴定管或移液管;100 mL容量瓶;烧杯、玻璃棒、胶头滴管;
(2)硝酸银见光易分解,要避光,所以标准硝酸银溶液用棕色滴定管盛装;滴定中眼睛应注视试剂瓶中颜色变化,出现砖红色沉淀,不再消失,说明氯离子完全反应,即达到滴定终点.
故答案为:硝酸银见光易分解;试剂瓶中颜色变化;砖红色沉淀,不再消失;
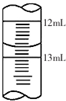
(3)滴定结束时,滴定管中液面如上图所示,则读数为12.70mL,故答案为:12.70mL;
(4)Ag++Cl-═AgCl↓
1 1
0.1000mol/L×12.50mL 10.00mL×C(Cl-)
解得:C(Cl-)=0.1250mol/L,即稀释后的酱油中NaCl的浓度为0.1250mol/L,
准确移取酱油样品5.00mL稀释至100mL,稀释后的酱油中NaCl的浓度为0.1250mol/L,则稀释前NaCl的浓度为$\frac{0.1250mol/L×100mL}{5.00mL}$=2.5mol/L,NaCl含量$\frac{2.5×58.5}{10}$g/100mL=14.625g/100mL,不符合标准;
故答案为:0.1250;不符合.
点评 本题综合考查物质的含量测定,涉及滴定原理,侧重分析能力、实验能力及计算能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
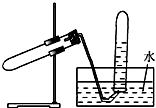 如图所示装置可用于( )
如图所示装置可用于( )| A. | 加热NaHCO3制CO2 | B. | 用Cu和浓HNO3反应制NO2 | ||
| C. | 用Zn与稀硫酸反应制H2 | D. | 用NaCl与浓H2SO4加热制HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 0 | 2 | 4 | 6 |
| V( 02 )/mL | 0.0 | 9.9 | 17.2 | 22.4 |
| A. | 0-2min的平均反应速率比4-6min快 | |
| B. | 0-6min 的平均反应速率v( H2O2)=3.3 x 10-2 moL-1•min-1 | |
| C. | 反应至 6min 时,c( H2O2)=0.3mol•L-1 | |
| D. | 反应至6min时,H2O2分解了 50% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 |
| A. | M的原子半径比Q的大 | |
| B. | L、T形成的简单离子核外电子数相等 | |
| C. | R、L、M三种元素的金属性依次增强 | |
| D. | Q、T两元素的氢化物的稳定性为H nT>H nQ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.6 g乙醇中含有的C-H键的个数为0.6NA | |
| B. | 34 gH2O2中含有的阴离子数为NA | |
| C. | 标准状况下,11.2 LCHCl3中含有的分子数为0.5NA | |
| D. | 9.2gNO2和N2O4混合气体中含有的原子总数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
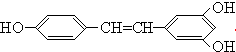 广泛存在于食物(例如桑葚、花生,尤其是葡萄)中,它可能具有抗癌性,下列关于白藜芦醇的说法错误的是( )
广泛存在于食物(例如桑葚、花生,尤其是葡萄)中,它可能具有抗癌性,下列关于白藜芦醇的说法错误的是( )| A. | 白藜芦醇属于三元醇,能与Na反应产生H2 | |
| B. | 能与NaOH反应,1mol该化合物最多能消耗NaOH 3mol | |
| C. | 能使FeCl3溶液显色 | |
| D. | 能与浓溴水反应,1mol该化合物最多能消耗溴6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与溴水在FeBr3作催化剂的条件下生成溴苯 | |
| B. | 由乙酸和乙醇制乙酸乙酯和由苯甲酸乙酯水解制苯甲酸和乙醇的反应类型不同 | |
| C. | 乙烯分子与苯分子中的碳碳键不同,但二者都能发生加成反应 | |
| D. |  与CH3CH2OH互为同系物 与CH3CH2OH互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化学键 | C═O | H-H | C-H | C-O | H-O |
| 键能/kJ•mol-1 | 803 | 436 | 414 | 326 | 464 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在整个化学反应过程中有2Q1+Q2═2Q | |
| B. | 根据能量守恒有Q1+Q2═Q | |
| C. | 由水蒸气分解为氢气和氧气的△H=(Q-Q1-Q2) kJ | |
| D. | 形成1 mol H-O键放出的能量为 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com