
【题目】氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,在空气中强烈发烟,易与水发生水解反应;熔点为-80℃,沸点137.l℃。在熔融的硫中通入氯气即可生成S2Cl2。如图是实验室用S和Cl2制备S2Cl2的装置(部分夹持装置已略去)。
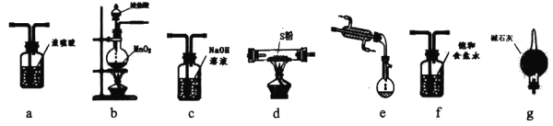
请回答:
(1)从上述提供的图片中选出必要的装置并排序以制备S2Cl2:b→___;
(2)已知S2Cl2水解时,只有一种元素的化合价发生了变化,且被氧化和被还原的该元素的物质的量之比为1:3,请写出该反应的化学方程式___。
【答案】fadeg 2S2Cl2+2H2O=SO2↑+3S↓+4HCl
【解析】
(1) S2Cl2易水解,因此需要严格无水,氯气需除杂并干燥,尾气需吸收过量的氯气并防止空气中的水进入,选择碱石灰进行尾气处理,据此分析和选择仪器;
(2)根据已知信息,结合氧化还原反应规律书写方程式。
(1) S2Cl2易水解,因此需要严格无水,氯气需除杂并干燥,尾气需吸收过量的氯气并防止空气中的水进入,选择碱石灰进行尾气处理,故排序bfadeg;
(2) S2Cl2中S化合价为+1,被氧化与被还原物质的量之比为1:3,产物为SO2与S,故水解方程式为2S2Cl2+2H2O=SO2↑+3S↓+4HCl。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】公元前一世纪,我国已使用天然气,天然气的主要成分为甲烷。下列关于甲烷的叙述中,错误的是
A. 通常情况下,甲烷跟强酸、强碱、强氧化剂不起反应
B. 甲烷化学性质比较稳定,不能被任何氧化剂氧化
C. 甲烷跟氧气反应无论生成CH3Cl、CH2Cl、CHCl3还是CCl4,都属于取代反应
D. 甲烷的四种取代物都难溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.淀粉、油脂、亚油酸的组成元素中均只含C、H、O
B.工业生产石油化工中的重要基础原料乙烯,主要原理是发生消去反应
C.3M防颗粒物口罩含有聚丙烯,聚丙烯属于高分子,不能使酸性高锰酸钾溶液褪色
D.将植物的秸杆、枝叶、杂草和人畜粪便加入沼气发酵池中,一定条件下生成沼气,属于生物质能的生物化学转换
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制备气体和验证气体性质的装置图。
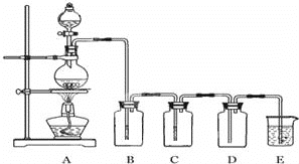
若利用如图装置实现碳和浓硫酸的反应,并进行如下验证:
①装置B、C、D、E中分别装有品红溶液、酸性KMnO4溶液、品红溶液、澄清石灰水,则D装置中品红溶液的作用是______,证明气体中有CO2的现象是______。
②若证明SO2具有氧化性,同时证明碳酸的酸性比硅酸的强,B、C、D中分别装有Na2S溶液、足量酸性KMnO4溶液、品红溶液。
则:B中的现象______,E中应加入______溶液,E中发生反应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处于平衡状态的反应2H2S(g)![]() 2H2(g)+S2(g) ΔH>0,合理的说法是( )
2H2(g)+S2(g) ΔH>0,合理的说法是( )
A. 加入催化剂,反应途径将发生改变,ΔH也将随之改变
B. 升高温度,正逆反应速率都增大,H2S分解率也增大
C. 增大压强,平衡向逆反应方向移动,将引起体系温度降低
D. 若体系恒容,注入一些H2后达新平衡,H2浓度将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现有下列八种物质:①食盐晶体;②乙醇;③冰醋酸(纯醋酸晶体);④NaHSO4;⑤KNO3溶液;⑥熔融的氢氧化钠;⑦液态氯化氢;⑧Cl2。
(1)填空回答(填序号):
a、以上物质属于非电解质的是______。
b、以上物质可以导电的是________。
(2)写出④溶于水时的电离方程式________。
Ⅱ.按要求回答下列问题:
(1)等质量的CO2和CO:所含气体的分子数之比为_____;
(2)实验室里盛放氢氧化钠溶液的试剂瓶瓶塞不能用玻璃塞,用离子方程式表示其中的原因_____;
(3)我国政府为了消除碘缺乏病,规定在食盐中必须加人适量的碘酸钾。检验食盐中是否加碘,可利用如下反应:KIO3 +KI+H2SO4 = K2SO4+ I2+H2O。
①将上面氧化还原反应的化学方程式配平___。
②如果反应中转移0.5mol电子,则生成I2的物质的量为_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个不同的容器中,在不同条件下利用N2+3H2==2NH3反应来合成氨,根据下列在相同时间内测定的结果判断,生成氨的速率最大的是 ( )
A. v(H2)=0.1 mol·(L·min)1B. v(N2)=0.01 mol·(L·s)1
C. v(N2)=0.2 mol·(L·min)1D. v(NH3)=0.3 mol·(L·min)1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液在下图装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
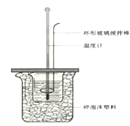
(1)环形玻璃搅拌棒_____(填能或不能)改为环形金属棒。其原因是________。
(2)大烧杯内填满碎泡沫塑料的作用______。
(3)实验中将氢氧化钠溶液分多次加入盐酸中,对求得中和热数值的影响是________(偏高或偏低或无影响)。
(4)如果改用60 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液进行反应,则与上述实验相比,所放出的热量_______(增加、减少或不变),所求中和热数值____(增加、 减少或 不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钒主要用于冶炼特种钢, 被誉为 “合金的维生素”。工业上常用富钒炉渣 (主要含FeO·V2O3, 还有少量P2O5等杂质) 制取钒的流程如下图。
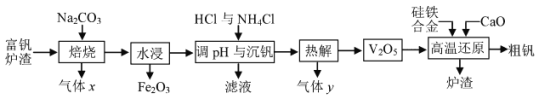
回答下列问题:
(1)已知焙烧中先发生4FeO·V2O3+5O2![]() 4V2O5+2Fe2O3反应, 其氧化产物是__,进一步生成可溶性NaVO3的反应方程式为______。
4V2O5+2Fe2O3反应, 其氧化产物是__,进一步生成可溶性NaVO3的反应方程式为______。
(2)25℃时,Ksp(NH4VO3)=4×10-2,电离平衡常数Kb(NH3·H2O) =1.8×10-5。“沉钒” 后VO3-的浓度为![]() mol/L,则滤液的pH为___。除OH-与VO3-外,滤液中还可能存在的阴离子是__。
mol/L,则滤液的pH为___。除OH-与VO3-外,滤液中还可能存在的阴离子是__。
(3) “热解” 过程产生的气体 y的电子式为__。
(4)硅参与高温还原反应的方程式为_____,炉渣的主要成分是__。
(5)钒比铁的金属性强。工业上通过电解精炼 “粗钒” 可得到99.5%的纯钒, 以熔融LiCl-KCl-VCl2为电解质,“粗钒” 中含少量铁和硅。则 “粗钒” 应连接电源的___极, 阴极的电极反应式为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com