
【题目】下列说法不正确的是( )
A.纯碱溶液清洗油污,加热可增强其去污能力
B.门窗玻璃、陶瓷餐具、玛瑙手镯、砖瓦所用材料为硅酸盐材料
C.聚丙烯酸钠是一种高吸水性树脂
D.汽油、煤油、植物油都是油,但它们的主要成分不相同
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案科目:高中化学 来源: 题型:
【题目】下列涉及有机物的说法中正确的是
A.乙烯、氯乙烯都是不饱和烃,均可用于合成有机高分子材料
B.煤的干馏可得到煤焦油,煤焦油蒸馏可得到苯、甲苯等芳香烃
C.在加热条件下,加入适量生石灰以除去乙酸乙酯中含有的乙醇杂质
D.淀粉和纤维素的水解产物都是葡萄糖,二者互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256 kJ的热量。
(1)此反应的热化学方程式为_______________________________________。
(2)又已知H2O(g)===H2O(l) ΔH=-44 kJ·mol-1则16 g液态肼与足量液态双氧水反应生成液态水时放出的热量为________kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是________________________________。
(4)发射卫星可用气态肼(N2H4)作燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气。已知:N2(g)+2O2(g)===2NO2(g) ΔH=+67.7 kJ·mol-1 N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1 气态肼和二氧化氮反应的热化学方程式为_______________________________。
(5)反应2H2+O2![]() 2H2O的能量变化如图所示。
2H2O的能量变化如图所示。
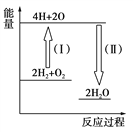
已知拆开1 mol H2、1 molO2和1 mol H—O中的化学键分别需要消耗436 kJ、496 kJ和463 kJ的能量。则反应过程(Ⅱ)________(填“吸收”或“放出”)________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、在下列物质转化中A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸,当X无论是强酸还是强碱时,都有如下的转化关系:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
当X是强酸时,A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E均含另外的同一种元素。请回答:
(1)A的化学式是______, Z的电子式是______。
(2)当X是强酸时,写出C→D的化学方程式:_____。
(3)当X是强碱时,写出E的稀溶液和铜反应生成C的离子方程式:_____。
II、在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O] (其相对分子质量为392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
(4)为了洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是____(填字母代号)。
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
(5)为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
①上表中第一次实验中记录数据明显大于后两次,其原因可能是_____(填字母代号)。
A.滴定前滴定管尖嘴无气泡,滴定结束有气泡
B.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
C.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
D.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
②通过实验数据计算的该产品纯度为_____(用字母a、c表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,X、Y、Q、W 都是惰性电极,将电源接通后,W极附近颜色逐渐加深.下列说法中错误的是( ) 
A.电源的M极为正极
B.甲装置中溶液的pH减小
C.甲装置的两个电极上都有单质生成且物质的量之比为1:1
D.欲用乙装置给铜镀银,U极应该是Ag,电镀液选择AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的性质说法正确的是
A.棉花和蛋白质都是高分子化合物,水解产物相同
B.苯和乙烯都能使溴水褪色,均与溴水发生加成反应
C.乙酸乙酯和油脂互为同系物
D.甲烷和乙醇均能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向10 mL 0.40 mol·L-1 H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示:
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
资料显示,反应分两步进行:① 2Fe3++H2O2 == 2Fe2++O2↑+2H+,② H2O2+2Fe2++2H+ == 2H2O+2Fe3+。反应过程中能量变化如下图所示。下列说法错误的是
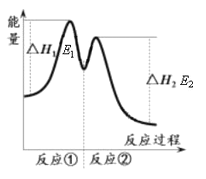
A. Fe3+的作用是增大过氧化氢的分解速率
B. 反应①是吸热反应、反应②是放热反应
C. 反应2H2O2(aq) == 2H2O(l)+O2(g)的ΔH=E1-E2<0
D. 0~6 min的平均反应速率:v(H2O2)=3.33×10-2 mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com