
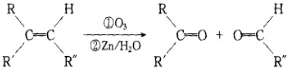
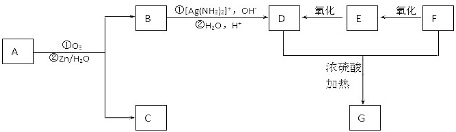
 +2H2O����Ӧ������������Ӧ��D��̼�����Ʒ�Ӧ�Ļ�ѧ����ʽ��HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2��+2H2O��
+2H2O����Ӧ������������Ӧ��D��̼�����Ʒ�Ӧ�Ļ�ѧ����ʽ��HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2��+2H2O������ A�������ԣ����ʵ���Ϊ0.0002mol��A����20.0 mL 0.0100mol/L��������ˮ��Һ���ζ��ﵽ�ζ��յ㣬˵��A����һ���Ȼ�����������̼���⡢����������Ϊ7.5��1.125��3��������Ԫ�ص���������Ϊ$\frac{3}{7.5+1.125+3}$=0.258�������������2����ԭ�ӣ�����Է�������Ϊ$\frac{32}{0.258}$=124����������3����ԭ�ӣ�����Է�������Ϊ$\frac{48}{0.258}$=186���л�������A����Է�����������150��С��200�����Է����к���3����ԭ�ӣ��������⣬������̼ԭ����Ϊ$\frac{7.5��48}{3��12}$=10����ԭ����Ϊ$\frac{1.125��48}{3}$=18������A�ķ���ʽΪC10H18O3��A��ʹ������Ȼ�̼��Һ��ɫ��˵��A����̼̼˫����A������������ԭˮ�ⷴӦ����B��C��B�ܷ���������Ӧ������������ƻ�����������Һ��Ӧ��˵��B�����Ȼ���ȩ����B������D��1molD��������̼��������Һ��Ӧ�ɷų�������̼44.8L����״������˵��D���������Ȼ���F������������D��˵��FΪ����D��F��Ũ���������¼��ȣ���������һ����ѧʽ������ʽ��ΪC4H4O4����Ԫ��G����GӦΪ �����Կ����Ƶ�FΪHOCH2CH2OH��EΪOHCCHO��DΪHOOCCOOH��BΪOHCCOOH���л�������Cû��֧����������û��-CH3�����������Ϣ��֪��CΪOHC��CH2��6CH2OH����AΪHOOCCH=CH��CH2��6CH2OH���ݴ˴��⣮
�����Կ����Ƶ�FΪHOCH2CH2OH��EΪOHCCHO��DΪHOOCCOOH��BΪOHCCOOH���л�������Cû��֧����������û��-CH3�����������Ϣ��֪��CΪOHC��CH2��6CH2OH����AΪHOOCCH=CH��CH2��6CH2OH���ݴ˴��⣮
��� �⣺A�������ԣ����ʵ���Ϊ0.0002mol��A����20.0 mL 0.0100mol/L��������ˮ��Һ���ζ��ﵽ�ζ��յ㣬˵��A����һ���Ȼ�����������̼���⡢����������Ϊ7.5��1.125��3��������Ԫ�ص���������Ϊ$\frac{3}{7.5+1.125+3}$=0.258�������������2����ԭ�ӣ�����Է�������Ϊ$\frac{32}{0.258}$=124����������3����ԭ�ӣ�����Է�������Ϊ$\frac{48}{0.258}$=186���л�������A����Է�����������150��С��200�����Է����к���3����ԭ�ӣ��������⣬������̼ԭ����Ϊ$\frac{7.5��48}{3��12}$=10����ԭ����Ϊ$\frac{1.125��48}{3}$=18������A�ķ���ʽΪC10H18O3��A��ʹ������Ȼ�̼��Һ��ɫ��˵��A����̼̼˫����A������������ԭˮ�ⷴӦ����B��C��B�ܷ���������Ӧ������������ƻ�����������Һ��Ӧ��˵��B�����Ȼ���ȩ����B������D��1molD��������̼��������Һ��Ӧ�ɷų�������̼44.8L����״������˵��D���������Ȼ���F������������D��˵��FΪ����D��F��Ũ���������¼��ȣ���������һ����ѧʽ������ʽ��ΪC4H4O4����Ԫ��G����GӦΪ �����Կ����Ƶ�FΪHOCH2CH2OH��EΪOHCCHO��DΪHOOCCOOH��BΪOHCCOOH���л�������Cû��֧����������û��-CH3�����������Ϣ��֪��CΪOHC��CH2��6CH2OH����AΪHOOCCH=CH��CH2��6CH2OH��
�����Կ����Ƶ�FΪHOCH2CH2OH��EΪOHCCHO��DΪHOOCCOOH��BΪOHCCOOH���л�������Cû��֧����������û��-CH3�����������Ϣ��֪��CΪOHC��CH2��6CH2OH����AΪHOOCCH=CH��CH2��6CH2OH��
��1����������ķ�����֪��A����Է��������� 186���û�����Ļ�ѧʽ��C10H18O3��
�ʴ�Ϊ��186��C10H18O3��
��2��HOOCCOOH��HOCH2CH2OH��Ũ���������·���������Ӧ���� ����Ӧ�ķ���ʽΪHOOCCOOH+HOCH2CH2OH$��_{��}^{ŨH_{2}SO_{4}}$
����Ӧ�ķ���ʽΪHOOCCOOH+HOCH2CH2OH$��_{��}^{ŨH_{2}SO_{4}}$ +2H2O��HOOCCOOH��̼�����Ʒ�Ӧ�Ļ�ѧ����ʽΪHOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2��+2H2O��
+2H2O��HOOCCOOH��̼�����Ʒ�Ӧ�Ļ�ѧ����ʽΪHOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2��+2H2O��
�ʴ�Ϊ��HOOCCOOH+HOCH2CH2OH$��_{��}^{ŨH_{2}SO_{4}}$ +2H2O��������Ӧ��HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2��+2H2O��
+2H2O��������Ӧ��HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2��+2H2O��
��3����������ķ�����֪��CΪOHC��CH2��6CH2OH���ʴ�Ϊ��OHC��CH2��6CH2OH��
���� ���⿼���л������ʽ��ȷ����ͬ���칹�����д�ȣ���Ŀ�Ѷ��еȣ�����Ԫ�������ȼ��ת����ϵȷ��A�Ľṹ�ǽ���Ĺؼ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
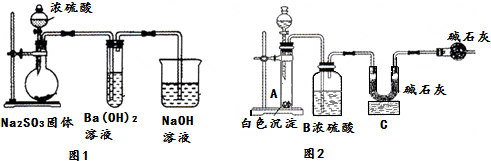
| ʵ�鲽�� | Ԥ����������� |
| ����1����������ɫ�������Թ��У�������������ˮ���μӼ���Ʒ����Һ | ��ɫ�������ܽ⣬��Һ�ʺ�ɫ�� |
| ����2���������Թ��еμ�����ϡ���ᣬ����� | �����������ܽ⣬���Тڣ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ��2L�����ܱ������г���2mol X��1mol Y������Ӧ��2X��g��+Y��g��?3Z��g������Ӧ���̳��������¶ȣ����X������������¶ȵĹ�ϵ��ͼ��ʾ�������ƶ���ȷ���ǣ�������
��2L�����ܱ������г���2mol X��1mol Y������Ӧ��2X��g��+Y��g��?3Z��g������Ӧ���̳��������¶ȣ����X������������¶ȵĹ�ϵ��ͼ��ʾ�������ƶ���ȷ���ǣ�������| A�� | Q��ʱ��Y��ת������� | |
| B�� | �����¶ȣ�ƽ�ⳣ������ | |
| C�� | W��X������Ӧ���ʵ���M��X������Ӧ���� | |
| D�� | ƽ��ʱ����Z���ﵽ��ƽ��ʱZ������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ͨ��ú��������Һ����ʹ̼���仯������Թ㷺Ӧ�ã�
ͨ��ú��������Һ����ʹ̼���仯������Թ㷺Ӧ�ã�| t/min | 0 | 1 | 2 | 3 | 4 |
| n��H2O��/mol | 0.600 | 0.520 | 0.450 | 0.350 | 0.350 |
| n��CO��/mol | 0.400 | 0.320 | 0.250 | 0.150 | 0.150 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | �û�����ķ���ʽΪC12H16O4 | |
| B�� | �û����������л����࣬���Կ��Է���ˮ�ⷴӦ | |
| C�� | �û�����ȿ��Է�����ȥ��Ӧ��Ҳ���Ա�����������ȩ | |
| D�� | 1mol�û�������Ժ�2mol���ᷢ��ȡ����Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ͼ�Dz��ֶ�����Ԫ��ԭ�ӣ�����ĸ��ʾ��������������ԭ�������Ĺ�ϵ��
��ͼ�Dz��ֶ�����Ԫ��ԭ�ӣ�����ĸ��ʾ��������������ԭ�������Ĺ�ϵ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com