
| A、c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH) |
| B、c(CH3COO-)+c(CH3COOH)=0.01 mol/L |
| C、c(CH3COO-)+c(OH-)-c(H+)=0.008 mol/L |
| D、c(H+)=0.002 mol/L |


科目:高中化学 来源: 题型:
| A、蒸发溶液时,边加热加搅拌,直至蒸发皿内的液体蒸干 |
| B、量取25.00LKMnO4溶液时,应选择酸式滴定管 |
| C、配制0.1mol/L的H2SO4溶液时,将量取的浓H2SO4注入容量瓶中加水稀释,边注入边搅拌 |
| D、配制一定物质的量浓度的溶液时,若未洗涤烧杯和玻璃棒,则会导致所配溶液的物质的量浓度偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(8n-m)mol |
| B、(4m-n)mol |
| C、(4n-m)mol |
| D、(7n-m)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用指南针确定航海方向 |
| B、培育新品种,增加农作物产量 |
| C、综合利用石油,合成优良人造纤维 |
| D、设计新程序,开发电脑新功能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、高空臭氧层吸收太阳紫外线,保护地球生物;反应3O2═2O3有单质参加,属于氧化还原反应 |
| B、人造纤维,合成纤维和光导纤维都是有机高分子化合物 |
| C、大量燃烧化石燃料排放的废气中含大量CO2、SO2造成大气污染,从而使雨水pH=5.6形成酸雨 |
| D、加热能杀死流感病毒是因为病毒的蛋白质受热变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||||
B、
| ||||
C、Cl-的粒子结构示意图为 | ||||
| D、不同的核素属于不同的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
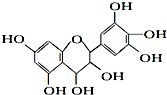
| A、该物质既可看作醇类,也可看作酚类 |
| B、1mol该物质可与4mol Br2反应 |
| C、1mol该物质可与7mol Na反应 |
| D、1mol该物质可与7mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 起始浓度(mol.L-l) | c(NH3) | c(O2) | c(NO) | c(H20) |
| 甲 | 1 | 2 | 0 | 0 |
| 乙 | 4 | 8 | 0 | 0 |
| 丙 | 0.2 | x | y | z |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com