
| A、用NaOH溶液滴定HCI与CH3COOH的混合溶液至中性时,溶液中的酸被完全中和 |
| B、0.1mol/LNa2CO3溶液35℃时的碱性比25℃时强,说明盐类水解反应是放热反应 |
| C、室温下,同浓度的Na2CO3溶液的pH比 Na2SiO3溶液的pH小,说明非金属性C>Si |
| D、焰色反应是化学变化 |


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
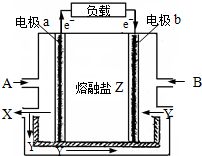 熔融碳酸盐燃料电池是以熔融的碳酸盐为电解质的燃料电池,其工作原理如图所示:
熔融碳酸盐燃料电池是以熔融的碳酸盐为电解质的燃料电池,其工作原理如图所示:| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 将溶液(或气体)X逐渐加入(或通入)到一定量Y溶液中,产生沉淀的质量与加入X的物质的量关系如图,符合图中情况的一组物质是( )
将溶液(或气体)X逐渐加入(或通入)到一定量Y溶液中,产生沉淀的质量与加入X的物质的量关系如图,符合图中情况的一组物质是( )| A | B | C | D | |
| X | Ba(HCO3)2 溶液 | Na2CO3 溶液 | KOH 溶液 | CO2 气体 |
| Y | NaOH 溶液 | CaCl2 溶液 | Mg(HSO4)2 溶液 | 石灰水 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除①外都对 | B、除⑥外都对 |
| C、④⑤不对 | D、全都正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化铁能与酸反应,可用于制作红色涂料 |
| B、氢氧化铝具有弱碱性,可用于制胃酸中和剂 |
| C、生石灰能与水反应,可用来干燥氯气 |
| D、氯化铝是一种电解质,可用于电解法制铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C+H2O═CO+H2△H=+131.3kJ?mol-1 | ||
B、H2(g)+
| ||
| C、2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ | ||
| D、C(s)+O2(g)═CO2(g)△H=+393.5kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同浓度、同体积的NaOH和氨水溶液中,水的电离程度相同 |
| B、升高温度,水的电离程度增大,c(H+)增大,pH<7,所以溶液显酸性 |
| C、向水中加入氨水,平衡逆向移动,水的电离受到抑制,所以c(OH-)降低 |
| D、向水中加入少量硫酸,c(H+)增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com