
【题目】实验室制备三氯乙醛(CCl3CHO)的反应原理为C2H5OH+4Cl2→CCl3CHO+5HCl,可能发生的副反应是C2H5OH+HCl→C2H5Cl+H2O。某探究小组模拟制备三氯乙醛的实验装置如图所示(夹持、加热装置均略去)。
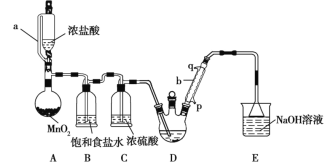
回答下列问题:
(1)用仪器a代替普通分液漏斗的目的是_______________。
(2)装置A中MnO2可以用KMnO4代替,反应可以在常温下进行,试写出反应的离子方程式________________。
(3)仪器b中冷凝水应从_______(填“p”或“q”)口进。
(4)若撤去装置B,对实验的影响是______________。
(5)已知:CCl3CHO+OH-→CHCl3+HCOO-;HCOO-+I2=H++2I-+CO2↑;I2+2S2O32-=2I-+S4O62-。称取0.40 g产品,配成待测溶液,加入20.00 mL 0.100 mol/L碘标准溶液,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,并立即用0.020 mol/L的Na2S2O3溶液滴定至终点。重复上述操作3次,平均消耗Na2S2O3溶液20.00 mL。滴定时所用指示剂是________,达到滴定终点时的现象是______________,测得该产品的纯度为_____。若滴定管用蒸馏水洗净后没有用Na2S2O3溶液润洗,则测定结果将_______(填“偏大”、“偏小”或“不变”)。
【答案】平衡气压,便于液体顺利滴下 【答题空2】2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O 【答题空3】p Cl2中的氯化氢杂质与乙醇反应,生成氯乙烷,导致三氯乙醛的纯度降低 淀粉溶液 滴入最后一滴 Na2S2O3 溶液,锥形瓶中的溶液由蓝色变为无色,且半分钟内不变色 【答题空7】66.4%或66% 偏小
【解析】
A装置利用二氧化锰与浓盐酸制备氯气,B装置用饱和食盐水除去HCl,C装置盛放浓硫酸干燥氯气,D中反应制备CCl3CHO,E装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl,防止污染空气。
(1)根据仪器a的结构确定a的名称;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气与水;
(3)冷凝管中水流方向与气流方向相反;
(4)撤去B装置,增大副反应C2H5OH+HCl→C2H5Cl+H2O的发生;
(5)碘遇淀粉溶液变蓝色,滴加Na2S2O3溶液会导致碘被还原,溶液的颜色会变浅,最终消失,根据消耗的Na2S2O3计算剩余I2的物质的量,进而计算与HCOO-反应的I2的物质的量,再根据关系式:CCl3CHO~HCOO-~I2计算。
(1)仪器a为恒压分液漏斗可以使浓盐酸溶液的液面上下气体压强一致,漏斗中的液体在重力作用下就可以顺利滴下;
(2)装置A中MnO2可以用KMnO4代替,反应可以在常温下进行,KMnO4将HCl氧化为Cl2,它本身被还原变为Mn2+,根据电子守恒、电荷守恒及原子守恒,可得反应的离子方程式:反应方程式为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(3)为了增强冷凝效果,要根据逆流原理,冷凝管中冷却水流方向为低进高出,即p进q出;
(4)B装置用饱和食盐水除去HCl,减少副反应发生,若撤去B装置,氯气中混有HCl,会增大副反应C2H5OH+HCl→C2H5Cl+H2O的发生,导致装置D中副产物C2H5Cl增多,三氯乙醛的纯度降低;
(5)根据碘遇淀粉溶液变蓝色的性质,可选择淀粉作指示剂,在滴加Na2S2O3溶液时,当观察到溶液蓝色变为无色,且半分钟内不变色,此时达到滴定终点;若滴定管用蒸馏水洗净后没有用Na2S2O3溶液润洗,则标准溶液的浓度偏小,根据标准溶液中含有的溶质物质的量计算的结构就会偏小;n(S2O32-)=0.020 mol/L×0.020L=4×10-4mol,剩余I2的物质的量n(I2)=![]() n(S2O32-)=2×10-4mol,与HCOO-反应的I2的物质的量为0.100mol/L×0.02L-2×10-4mol=1.8×10-3mol,由CCl3CHO~HCOO-~I2可知,CCl3CHO的物质的量n(CCl3CHO)= n(I2)=1.8×10-3mol,则该产品的纯度为
n(S2O32-)=2×10-4mol,与HCOO-反应的I2的物质的量为0.100mol/L×0.02L-2×10-4mol=1.8×10-3mol,由CCl3CHO~HCOO-~I2可知,CCl3CHO的物质的量n(CCl3CHO)= n(I2)=1.8×10-3mol,则该产品的纯度为![]() =66.4%,或写为66%。
=66.4%,或写为66%。


科目:高中化学 来源: 题型:
【题目】Ⅰ、实验室要配制物质的量浓度为0.1 mol/L的NaOH溶液480 mL
(1)填表:
配制时应称量NaOH的质量/g | 已给仪器 | 配制时除已给仪器外还需要的其他仪器 |
__________ | 烧杯、药匙、托盘天平 | ____________________________ |
(2)若要计算该溶液溶质的质量分数,还需要的一个条件是______________(用文字说明)。
(3)下列操作对配制的NaOH溶液浓度有偏高影响的是_________________(填字母)
A.称量NaOH固体时,露置在空气的时间过长
B.选用的容量瓶内有少量的蒸馏水
C.在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
D.在定容时仰视容量瓶刻度线
Ⅱ、实验室用下图几个实验装置,可快速制取少量气体,并进行相关性质实验。

(1)若 A为30%H2O2溶液,B为MnO2 ,C盛有氢硫酸(H2S)饱和溶液,旋开E后,C中出现浅黄色浑浊的现象,写出C中发生反应的化学方程式:______________________________________。
(2)若A中装有浓盐酸,B中装有固体KMnO4 ,C中盛有KI淀粉溶液,旋开E后,B中出现黄绿色气体。已知1 mol KMnO4发生反应时转移5mol电子。则B中发生反应的离子方程式是:_______;C中的现象是:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件关于离子共存说法中正确的是

A.a点对应的溶液中大量存在:CO32-、Na+、Cl-、SO42-
B.b点对应的溶液中大量存在:Fe2+、Ba2+、K+、NO3-
C.c点对应的溶液中大量存在:Na+、Ba2+、Cl-、Al3+
D.d点对应的溶液中大量存在:Na+、K+、ClO-、Cl—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是一个远未完全开发的巨大化学资源宝库,海洋资源的综合利用具有非常广阔的前景。回答下列问题:
(1)据媒体报道,挪威和荷兰正在开发一种新能源盐能。当海水和淡水混合时,温度将升高0.1℃,世界所有入海口的这种能源相当于电力需求的20%。海水和淡水混合时,温度升高最可能的原因是______。
A.发生了盐分解反应
B.发生了水分解反应
C.由于浓度差产生放热
D.盐的溶解度增大
(2)蒸馏法是人类最早使用的淡化海水的方法。你认为蒸馏法淡化海水最理想的能源是_______。
(3)从海水中可得到多种化工原料和产品,如图是利用海水资源的流程图。

①反应Ⅱ的离子方程式为_________。
②从反应Ⅲ后的溶液中得到纯净的单质溴的实验操作方法是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积为2 L的固定密闭容器中通入3 mol X气体,在一定温度下发生如下反应:2X(g)![]() Y(g)+3Z(g)。
Y(g)+3Z(g)。
(1)经5 min后反应达到平衡,此时测得容器内的压强为起始时的1.2倍,则用Y表示的速率为________ mol·L-1·min-1。
(2)若向达到(1)的平衡体系中充入氦气,则平衡______(填“向左”、“向右”或“不”)移动;若从达到(1)的平衡体系中移走部分Y气体,则平衡________(填“向左”、“向右”或“不”)移动。
(3)若在相同条件下向达到(1)所述的平衡体系中再充入0.5 mol X气体,则平衡后X的转化率与(1)的平衡中X的转化率相比较________。
A.无法确定 B.前者一定大于后者 C.前者一定等于后者 D.前者一定小于后者
(4)若保持温度和压强不变,起始时加入X、Y、Z物质的量分别为a mol、b mol、c mol,达到平衡时仍与(1)的平衡等效,则:a、b、c应该满足的关系为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃ 时,0.1 mo1·L-1某一元酸HA在水中有0.1%发生电离,下列叙述正确的是
A. 该溶液的pH=3
B. 升高温度,溶液的pH增大
C. 此酸的电离方程式为HA=H+ + A-
D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图:
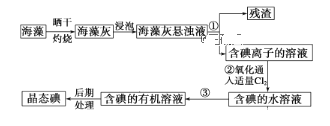
(1)指出提取碘的过程中①的实验操作名称_________及玻璃仪器名称______________________________________。
(2)写出过程②中有关反应的离子方程式:_____________________。
(3)操作③的名称_____________,用到的主要仪器_____________。
(4)提取碘的过程中,可供选择的有机试剂是(______)。
A.酒精 B.四氯化碳 C.甘油 D.醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某固体有机物A的分子组成,测定装置如图(铁架台、铁夹、酒精灯等未画出):

取17.1 g A放入装置中,通入过量O2燃烧,生成CO2和H2O,请回答下列有关问题:
(1)通入过量O2的目的______________________。
(2)C装置的作用是_____________________________。D装置的作用是_____________________。
(3)通过该实验,能否确定A中是否含有氧原子?__________。
(4)若A的摩尔质量为342 g/mol,C装置增重9.90 g,D装置增重26.4 g,则A的分子式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A (C2H4)是基本的有机化工原料。用A和常见的有机物可合成一种醚类香料和一种缩醛类香料,具体合成路线如图所示(部分反应条件略去):
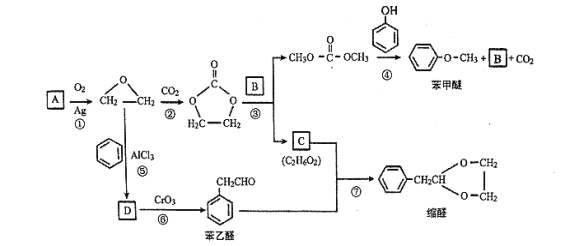
已知:![]()
回答下列问题:
(1)B的分子式是_______,C中含有的官能团名称是_______。
(2)若D为单取代芳香族化合物且能与金属钠反应;每个D分子中只含有1个氧原子, D中氧元素的质量分数约为13.1%,则D的结构简式为_______,⑥的反应类型是_______。
(3)据报道,反应⑦在微波辐射下,以NaHSO4·H2O为催化剂进行,请写出此反应的化学方程式:_______。
(4)请写出满足下列条件的苯乙醛的所有同分异构体的结构简式:_______。
i .含有苯环和结构![]()
ii.核磁共振氢谱有4组峰,且峰面积之比为3 : 2 : 2 : 1
(5)若化合物E为苯甲醚的同系物,且相对分子质量比苯甲醚大14,则能使FeCl3溶液显色的E的所有同分异构体共有_______ (不考虑立体异构)种。
(6)参照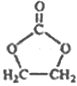 的合成路线,写出由2-氯丙烷和必要的无机试剂制备
的合成路线,写出由2-氯丙烷和必要的无机试剂制备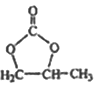 的合成流程图:_______。
的合成流程图:_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com