
下列说法正确的是()
A. 需要加热方能发生的反应一定是吸热反应
B. 若反应为放热反应,则该反应不必加热就可发生
C. 放热反应比吸热反应容易发生
D. 化学反应总是伴随着能量的变化
考点: 化学能与热能的相互转化.
专题: 化学反应中的能量变化.
分析: A.很多放热反应也需要加热;
B.很多放热反应也需要加热;
C.反应是否容易发生,与放热、吸热无关;
D.化学反应时旧键断裂要吸收能量,新键形成要放出能量.
解答: 解:A.很多放热反应也需要加热,如碳的燃烧,属于需要加热方能发生的反应不一定是吸热反应,故A错误;
B.很多放热反应也需要加热,如很多燃烧反应也需要加热,故B错误;
C.反应是否容易发生,与放热、吸热无关,有些吸热反应常温下也很容易发生,如碳酸氢铵分解,故C错误;
D.化学反应时旧键断裂要吸收能量,新键形成要放出能量,所以化学反应总是伴随着能量的变化,故D正确;
故选D.
点评: 本题考查化学反应能量的变化,题目难度不大,注意有关概念的理解,学习中注意积累.


科目:高中化学 来源: 题型:
铜合金是人类使用最早的金属材料,铜在化合物中的常见化合价有+l、+2.已知Cu2O与稀硫酸反应,溶液呈蓝色.现向Cu、Cu2O和CuO组成的混合物中,加入1L 0.6mol/L HNO3溶液恰好使混合物溶解,同时收集到2240mL NO气体(标准状况).请回答下列问题:
(1)写出Cu2O跟稀硝酸反应的离子方程式
(2)若将上述混合物用足量的H2加热还原,所得到固体的质量为 .
(3)若混合物中含0.1mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为 .
(4)若混合物中Cu的物质的量为n mol,则n的取值范围为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是()
A. 任何化学反应都伴随着能量的变化
B. 1 mol H2SO4和1 mol Ba(OH)2完全反应所放出的热量称为中和热
C. 在101 kPa时,1 mol碳燃烧放出的热量就是碳的燃烧热
D. 热化学方程式未注明温度和压强时,△H表示标准状况下的数据
查看答案和解析>>
科目:高中化学 来源: 题型:
将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)═2C(g),反应2min的时间,并测得该段时间内C的反应速率为0.6mol•L﹣1•min﹣1,现有下列几种说法中正确的是()
①用物质A表示的反应的平均速率为0.6mol•L﹣1•s﹣1
②用物质B表示的反应的平均速率为0.05mol•L﹣1•s﹣1
③2min时容器中A的物质的量为2.8mol
④2min时物质B的浓度为0.4mol•L﹣1.
A. ①③ B. ②④ C. ②③ D. ④
查看答案和解析>>
科目:高中化学 来源: 题型:
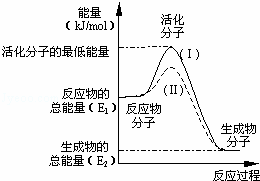
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才能发生化学反应.能引发化学反应的碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位用kJ•mol﹣1表示.请认真观察下图,然后回答问题.
(1)图中反应是 (填“吸热”或“放热”)反应,该反应 (填“需要”或“不需要”)提供能量,该反应的△H= (用含E1、E2的代数式表示).
(2)已知热化学方程式:H2(g)+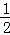 O2(g)═H2O(g)△H=﹣241.8kJ•mol﹣1,该反应的活化能为167.2kJ•mol﹣1,则其逆反应的活化能为 .
O2(g)═H2O(g)△H=﹣241.8kJ•mol﹣1,该反应的活化能为167.2kJ•mol﹣1,则其逆反应的活化能为 .
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
充分燃烧一定量丁烷气体放出的热量为Q,完全吸收它生成的CO2生成正盐,需要5mol•L﹣1 的KOH溶液100mL,则丁烷的燃烧热为()(单位:kJ/mol)
A. 16Q B. 8Q C. 4Q D. 2Q
查看答案和解析>>
科目:高中化学 来源: 题型:
将V1mL 1.0mol•L﹣1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示
mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示 (实验中始终保持V1+V2=50mL).下列叙述正确的是()
(实验中始终保持V1+V2=50mL).下列叙述正确的是()
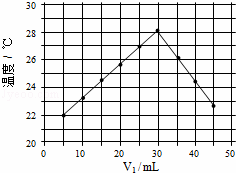
A. 做该实验时环境温度为20℃
B. 该实验表明化学能可能转化为热能
C. NaOH溶液的浓度约为1.0mol/L•L﹣1
D. 该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
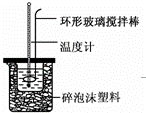
实验室用50mL 0.50mol•L﹣1盐酸、50mL 0.55mol•L﹣1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
实验次数 起始温度t1/℃ 终止温度t2/℃
盐酸 NaOH溶液
1 20.2 20.3 23.7
2 20.3 20.5 23 .8
.8
3 21.5 21.6 24.9
完成下列问题:
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是 .
(2)在操作正确的前提下,提高中和热测定准确性的关键是: .
(3)根据上表中所测数据进行计算,则该实验测得的中和热△H= .如用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将 (填“偏大”、“偏小”、“不变”).
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温 较高
较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com