
| A. | 胶体区别于其他分散系的本质原因是具有丁达尔效应 | |
| B. | 静电除尘除去空气中的飘尘是利用了胶体粒子的带电性 | |
| C. | 从颜色上无法区别FeCl3溶液和Fe(OH)3胶体 | |
| D. | 在江河入海处容易形成沙洲与胶体的聚沉无关 |
分析 A.胶体区别于其他分散系的本质特征是分散质微粒直径的大小不同;
B.胶体具有电泳现象;
C.Fe(OH)3胶体呈红褐色,FeCl3溶液呈棕黄色;
D.胶体遇到电解质发生聚沉.
解答 解:A.胶体区别于其它分散系的本质特征是胶体粒子直径在1-100nm之间,溶液的粒子直径小于1nm,浊液的子直径大于100nm,故A错误;
B.中和胶体粒子的电性能够使胶体发生电泳,如用净电除尘器吸附带电的飘尘,而使之电泳除去,故B正确;
C.Fe(OH)3胶体呈红褐色,FeCl3溶液呈棕黄色,因此可以从颜色上区分,故C错误;
D.由于同种电荷的静电排斥作用,胶体相对比较稳定,海水中含电解质使胶体发生聚沉,在江河入海处容易形成沙洲和胶体有关,故D错误;、
故选B.
点评 本题考查胶体的性质,比较基础,侧重对基础知识的巩固,注意对基础知识的理解掌握,题目难度不大.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 1molH2O所含有的原子数为NA | |
| B. | 常温常压下,11.2LCl2所含的分子数为0.5NA | |
| C. | 常温常压下,32g O2含有的氧原子数为2NA | |
| D. | 1L0.1mol/LNa2SO4溶液中所含的Na+为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
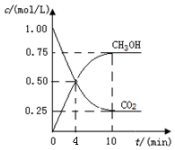 二氧化碳催化加氢合成甲醇的反应:
二氧化碳催化加氢合成甲醇的反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用烧杯盛氢氧化钠称量 | |
| B. | 浓硫酸溶解后立即转移到容量瓶内 | |
| C. | 用量筒量硫酸时俯视刻度 | |
| D. | 用量筒量硫酸时,倾倒后量筒没有洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| A组 | B组 | C组 | D组 | |
| 分类标准 | 非金属单质 | 金属单质 | 金属氧化物 | 酸 |
| 不属于该类的物质 | Al | N2 | SO2 | NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 烧碱的分子式为NaOH | |
| B. | 中子数为15的硅原子:${\;}_{14}^{20}$Si | |
| C. | 乙醇的结构简式:C2H5OH | |
| D. | NH3•H2O的电离方程式:NH3•H2O?NH4++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H11Cl的有机物有8种同分异构体 | |
| B. | 塑料的老化是因为其主要成分在空气中发生了缓慢的加成反应 | |
| C. | 乙醇和乙酸都能与碳酸氢钠溶液反应 | |
| D. | 富含糖类和蛋白质的物质都易被人体消化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com