
| 消耗量 |
| 起始量 |
| 生成物平衡浓度幂次方乘积 |
| 反应物平衡浓度幂次方乘积 |
| 消耗量 |
| 起始量 |
| 0.5mol |
| 2.5mol |
| 33 |
| 12×2 |


科目:高中化学 来源: 题型:
| A、无色溶液中:Na+、MnO4-、SO42-、K+ |
| B、使蓝色石蕊试纸变红的溶液中:K+、S2-、NO3-、OH- |
| C、加入Al能放出H2的溶液中:K+、NH4+、NO3-、Cl- |
| D、含有大量Fe3+的溶液中:Al3+、Cu2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 0 | 20 | 40 | 60 | 80 | |
| c(N2O4)mol?L-1 | 0.100 | a | 0.050 | c | d |
| c(NO2)/mol?L-1 | 0.000 | 0.060 | b | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化学 来源: 题型:
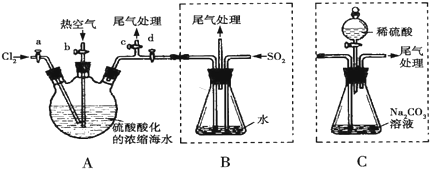
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(K+) |
| c(S2-) |
| A、②④ | B、①②⑤ |
| C、③④⑤ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
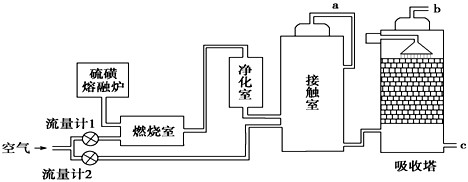
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢气在空气中燃烧 |
| B、盐酸与氢氧化钠中和反应 |
| C、Ba(OH)2?8H2O与NH4Cl固体混合反应 |
| D、金属Zn与盐酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2与F2反应的热化学方程式为:H2(g)+F2(g)=2HF(g);△H=-541 kJ |
| B、2 L HF气体分解成1 L H2和1 L F2吸收541 kJ的热量 |
| C、在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 |
| D、1 mol H2与1 mol F2反应生成2 mol液态HF放出热量小于541 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+一定存在 |
| B、100mL溶液中含0.01mol CO32- |
| C、Cl-一定存在 |
| D、Ba2+一定不存在,Mg2+可能存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com