
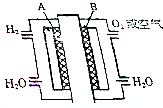
 为体现“绿色奥运”“科技奥运”,2008年北京奥运会出现了中国自己生产的燃料电池汽车,它是以铂作电极,硫酸溶液作电解液,其工作原理如图所示;
为体现“绿色奥运”“科技奥运”,2008年北京奥运会出现了中国自己生产的燃料电池汽车,它是以铂作电极,硫酸溶液作电解液,其工作原理如图所示;分析 在燃料电池中,通入燃料的电极是负极,该极上发生失电子的氧化反应,通入氧气的电极是正极,该极上氧气得电子发生还原反应,电解质溶液中阴离子向负极移动.
解答 解:(1)燃料电池把化学能转化为电能,通入燃料的电极是负极,该极上发生失电子的氧化反应,所以负极反应为:H2-2e-═2H+;
故答案为:化学;H2-2e-═2H+;
(2)在燃料电池中,电解质溶液中阴离子向负极移动,所以SO42-移向A极;
故答案为:A;
(3)该反应总反应为氢气与氧气燃烧生成水,所以电解液硫酸被稀释,则PH变大,故答案为:变大.
点评 本题考查学生燃料电池的工作原理知识,注意把握正负极的判断、电极方程式的书写、离子移动方向等内容,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | 0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)(mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| 实验 编号 | T(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性SiH4<PH3<NH3<H2O | B. | 熔点:Na>K>Rb>Cs | ||
| C. | 酸性:H2CO3<H3PO4<H2SO4<HClO4 | D. | 半径:K+>Na+>O2->F- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①③④⑤⑥ | C. | ②③⑤⑥ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 亚磷酸三乙酯[P(OC2H5)3]常用作塑料稳定剂、增塑剂,也用作医药、农药的中间体.其合成原理为PCl3+3C2H5OH$\stackrel{△}{→}$P(OC2H5)3+3HCl
亚磷酸三乙酯[P(OC2H5)3]常用作塑料稳定剂、增塑剂,也用作医药、农药的中间体.其合成原理为PCl3+3C2H5OH$\stackrel{△}{→}$P(OC2H5)3+3HCl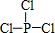 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 同周期元素中X的金属性最强 | |
| B. | 原子半径X>Y,离子半径X+>Z2- | |
| C. | 同族元素中Z的氢化物沸点最低 | |
| D. | 同周期元素中Y的最高价含氧酸的酸性最强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com