
【题目】下列属于氧化还原反应的是( )
A.NH4Cl+NaOH ![]() NH3↑+NaCl+H2O
NH3↑+NaCl+H2O
B.MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
C.Na2O2+2H2O=2NaOH+H2O2
D.SO2+H2O=H2SO3
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
【题目】研究表明许多疾病,包括基因突变(癌变、动脉硬化等)和生物机体中毒等,可能是一氧化氮的释放或调节不正常引起的。用间接电化学法可对NO进行无害化处理,其原理如图所示(质子膜允许H+和H2O通过),下列相关判断不正确的是 ( )
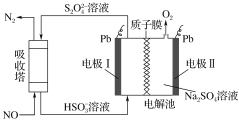
A.电极Ⅰ接电源负极,电极反应式为2HSO3-+2H++2e-==S2O42-+2H2O
B.质子从电极Ⅱ通过质子膜向电极Ⅰ作定向移动
C.吸收塔中的反应为2NO+2S2O42-+2H2O==N2+4HSO3-
D.每处理2 mol NO,电解池质量减少32 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化①~⑧为各装置中的电极编号。当K闭合后,下列说法正确的有

①D装置中纯Cu电极反应为:Cu2++2e-=Cu
②整个电路中电子的流动方向为:③→②;①→③;⑦→⑥;⑤→④
③装置原理上是一个电镀池(Ag表面镀Cu),其中Cu作阴极,Ag作阳极
④A装置中C电极反应为:O2+4e-+2H2O=4OH-
A.①②B.③④C.②③④D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰硫酸(NOSO4H)主要用于染料、医药等工业。实验室制备亚硝酰硫酸的方法如下:将SO2通入盛有浓硫酸和浓硝酸的混合液中,维持体系温度略低于20℃,搅拌,使其充分反应。反应过程中,亚硝酰硫酸的物质的量和硝酸的物质的量随时间的变化如图所示。
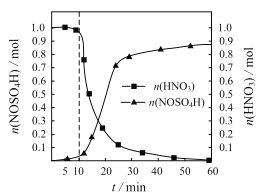
(1)①实验室制备NOSO4H的化学反应方程式为___。
②反应进行到10min后,反应速度明显加快,其可能的原因是___。
③反应过程中,硝酸减少的物质的量大于NOSO4H生成的物质的量的可能原因是___
(2)为了测定亚硝酰硫酸的纯度,进行如下实验:。
准确称取1.200g产品放入锥形瓶中,加入50.00mL0.1000mol·L-1的KMnO4标准溶液和足量稀H2SO4,摇匀,使其充分反应。再将反应后溶液加热至60~70℃(使生成的HNO3挥发逸出),冷却至室温,用0.2500mol·L-1Na2C2O4标准溶液滴定至终点,消耗Na2C2O4溶液的体积为16.00mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4;KMnO4在酸性条件下被还原为Mn2+。
根据以上实验数据计算亚硝酰硫酸的纯度。(写出计算过程)___
查看答案和解析>>
科目:高中化学 来源: 题型:
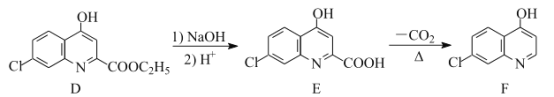
【题目】氯喹是合成一种抑制病毒药物的中间体,其合成路线如图:
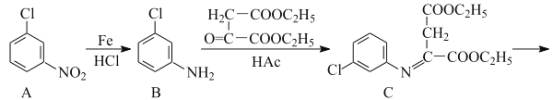
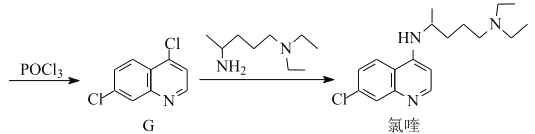
(1)D中含氧官能团的名称为___和___。
(2)A→B的反应类型为___。
(3)C→D的反应中有副产物X(X与D互为同分异构体)生成,写出X的结构简式:
___。
(4)E的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:___。
①酸性条件下水解得到的两种有机产物,都能发生银镜反应,其中一种与FeCl3溶液发生显色反应;
②分子中有氰基(-CN),有一个手性碳原子,有4种不同化学环境的氢。
(5)已知:①![]() NH2易被氧化;
NH2易被氧化;
②酰氯(![]() Cl)的氯原子比氯代烃的更易被取代
Cl)的氯原子比氯代烃的更易被取代
③![]() RHC=N-CH2R’
RHC=N-CH2R’
写出以![]() 和
和![]() 为原料制备
为原料制备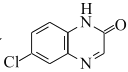 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)___。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.碳酸氢钠的水解方程式:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
B.用高锰酸钾标准溶液滴定草酸:2MnO4-+6H++5H2C2O4=2Mn2++10CO2↑+8H2O
C.用碳酸氢钠溶液检验水杨酸中的羧基: +2HCO3-→
+2HCO3-→ +2H2O+2CO2↑
+2H2O+2CO2↑
D.向Na2SiO3溶液中滴加稀盐酸:Na2SiO+2H+=H2SiO3↓+2Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.40 | 0.10 | 0.090 |
② | 800 | 0.10 | 0.40 | 0.080 |
③ | 800 | 0.20 | 0.30 | a |
④ | 900 | 0.10 | 0.15 | b |
下列说法不正确的是( )
A.实验①中,若5min未测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速v(N)=1.0×10-3mol·L-1·min-1
B.实验②中,达到平衡时,Y的转化率为20%
C.实验③中,该反应的平衡常数K=1.0
D.实验④中,达到平衡时, b>0.060
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向浓度均为0.1mol·L-1、体积均为100mL的两种一元酸HX、HY溶液中分别加入NaOH固体,溶液中![]() 随n(NaOH)的变化如图所示。下列说法正确的是
随n(NaOH)的变化如图所示。下列说法正确的是

A.HX为弱酸,HY为强酸
B.水的电离程度:b>c>d
C.C点对应的溶液中:c(HY)>c(Y-)
D.若将c点与d点的溶液全部混合,溶液中离子浓度大小:c(Na+)>c(X-)>c(Y-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述不正确的是( )


A.用图①装置实现铁上镀铜,a极为铜,电解质溶液可以是CuSO4溶液
B.图②装置盐桥中KCl的Cl-移向右烧杯
C.图③装置中钢闸门应与外接电源的负极相连获得保护
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com