D
试题分析:过氧化钠中氧元素由—1价变为0价和—2价,化合价升降总数等于转移电子数,则2Na
2O
2+2CO
2=2Na
2CO
3+O
2~2e
—,由于过氧化钠与转移电子的系数之比等于物质的量之比,则2mol过氧化钠与足量二氧化碳充分反应转移2mol电子,所以1mol过氧化钠与足量二氧化碳充分反应转移1mol电子,故A选项错误;由于c(H
+)=10
—pHmol/L,则pH=1的醋酸溶液中氢离子浓度为0.1mol//L,由于醋酸是部分电离出氢离子的弱酸,则醋酸的浓度大于0.1mol/L,由于n=c?V,缺少溶液的体积或溶液体积不一定是1L,则醋酸分子的物质的量不一定大于0.1mol,故B选项错误;由于碘离子的还原性大于亚铁离子,FeI
2=Fe
2++2I
—中碘离子与亚铁离子的系数之比等于物质的量之比,当1mol Fe
2+被氧化Fe
3+为时,2molI
—也会被氧化为I
2,即Fe
2++2I
—+3/2Cl
2=Fe
3++3Cl
—+I
2~3e
—,由于转移电子与亚铁离子的系数之比等于物质的量之比,则1mol Fe
2+被氧化时,总共转移3mol电子,故C选项错误;由于c(H
+)=10
—pHmol/L,则pH=6的纯水中氢离子浓度为10
—6 mol//L,由于n=c?V,则1L纯水中水电离出的氢离子的物质的量为10
—6 mol,由于H
2O
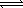
H
++OH
—中氢氧根离子与氢离子的系数之比等于物质的量之比,则1L纯水中的氢氧根离子的物质的量为10
—6 mol,故D选项正确。
考点:考查阿伏加德罗常数,涉及体积、气体摩尔体积、物质的量、氧化还原反应、物质的量在化学或电离方程式计算中的应用、物质的量浓度、强电解质、物质的组成、水的离子积、溶液的pH、电离方程式等。

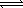 H++OH—中氢氧根离子与氢离子的系数之比等于物质的量之比,则1L纯水中的氢氧根离子的物质的量为10—6 mol,故D选项正确。
H++OH—中氢氧根离子与氢离子的系数之比等于物质的量之比,则1L纯水中的氢氧根离子的物质的量为10—6 mol,故D选项正确。
