
| 0.003×0.05-0.001×0.05 |
| 0.1 |
| 10-12 |
| 0.001 |


科目:高中化学 来源: 题型:
| A、金属钠意外着火时,立即用沾水的毛巾覆盖 |
| B、当有大量氯气泄漏时,人应沿顺风方向疏散 |
| C、将含有硫酸的废液倒入水池,用大量水冲入下水道 |
| D、严禁在加油站附近放烟花爆竹 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使甲基橙变红色的溶液:Na+、Mg2+、Cl-、SO42- |
| B、0.1mol?L-1 NaHCO3溶液:Na+、Ba2+、NO3-、OH- |
| C、滴加KSCN 溶液显红色的溶液:NH4+、K+、Cl-、I- |
| D、由水电离出的c(H+)=10-12mol?L-1的溶液:Na+、K+、NO3-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤ | B、②④⑤⑥ |
| C、①③④⑤⑥ | D、①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
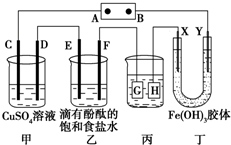 如图所示装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中的溶液都是1mol?L-1 500mL(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.请回答:
如图所示装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中的溶液都是1mol?L-1 500mL(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
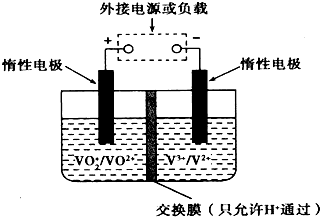 钒(V)及其化合物广泛应用于工业催化,新材料和心能源等领域.
钒(V)及其化合物广泛应用于工业催化,新材料和心能源等领域.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com