
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )
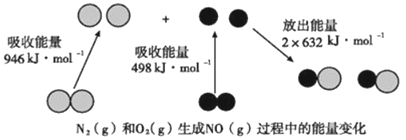
A. 1mol N2(g)和1mol O2(g)完全反应放出的能量为180kJ
B. 通常情况下,N2(g)和O2(g)混合能直接生成NO
C. 1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量
D. NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
【答案】C
【解析】
A.根据题给数据可知,反应物中化学键断裂吸收能量:(946+498)=1444kJ/mol,生成物中化学键的形成放出能量2×632=1264kJ/mol,故1molN2(g)和1molO2(g)反应吸收的能量为180kJ,故A错误;
B.N2(g)和O2(g)的反应需要在放电条件下进行,通常情况下,N2(g)和O2(g)混合不能直接生成NO,故B错误;
C.根据题给数据知,N2(g)和O2(g)的反应是吸热反应,1molN2(g)和1molO2(g)具有的总能量小于2molNO(g)具有的总能量,故C正确;
D.一氧化氮不能和氢氧化钠反应,属于不成盐氧化物,故D错误。
故选C。


科目:高中化学 来源: 题型:
【题目】某研究性学习小组为确定一种从煤中提取的液态烃X的结构,对其进行探究。

步骤一:这种碳氢化合物蒸气通过热的氧化铜(催化剂),氧化成二氧化碳和水,再用装有无水氯化钙和固体氢氧化钠的吸收管完全吸收。2.12g有机物X的蒸气氧化产生7.04g二氧化碳和1.80g水。
步骤二:通过仪器分析得知X的相对分子质量为106。
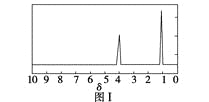
步骤三:用核磁共振仪测出X的1H核磁共振谱有2个峰,其面积之比为2∶3。如图Ⅰ。
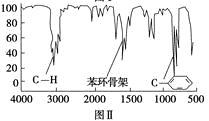
步骤四:利用红外光谱仪测得X分子的红外光谱如图Ⅱ。
试填空:
(1)X的分子式为________;X的名称为 。
(2)步骤二中的仪器分析方法称为________。
(3)写出X与足量浓硝酸和浓硫酸混合物反应的化学方程式: 。
(4)写出X符合下列条件的同分异构体结构简式 。
①芳香烃 ②苯环上一氯代物有三种
(5)X以醋酸为溶剂在催化剂作用下用氧气氧化得到另一种重要的化工原料PTA,查阅资料得知PTA的溶解度:25 ℃时0.25 g、50 ℃时0.97 g、95 ℃时7.17 g。得到的粗产品中有部分不溶性杂质,请简述实验室中提纯PTA的实验方案: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】aXn和bYm为两主族元素的离子,它们的电子层结构相同,下列判断错误的是( )。
A. 原子半径:X<Y
B. Y最高价氧化物的化学式为YOm
C. a+n=b-m
D. X的氢化物的化学式为HnX
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 石油是混合物,汽油是纯净物B. 石油中只含有液态烷烃
C. 石油含有碳、氢、硫、氧、氮等元素D. 石油具有固定的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某钠盐溶液中可能含有![]() 等阴离子。某同学取5份此溶液样品,分别进行了如下实验:
等阴离子。某同学取5份此溶液样品,分别进行了如下实验:
①用pH计测得溶液pH大于7
②加入盐酸,产生有色刺激性气体
③加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体
④加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色
⑤加足量BaCl2溶液,产生白色沉淀,在滤液中加入酸化的(NH4)2Fe(SO4)2溶液,再滴加KSCN溶液,显红色
该同学最终确定在上述六种离子中只含![]() 三种阴离子。
三种阴离子。
请分析,该同学只需要完成上述哪几个实验,即可得出此结论。( )
A. ①②④⑤ B. ③④ C. ③④⑤ D. ②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的微粒在指定溶液中一定能大量共存的是( )
A. c(FeCl3)=1.0 mol·L-1的溶液中:HCO![]() 、Cl-、H+、Na+
、Cl-、H+、Na+
B. 常温下,由水电离出的c(H+)=10-14mol·L-1溶液中:NH![]() 、K+、CO
、K+、CO![]() 、SO
、SO![]()
C. 在c(HCO![]() )=0.1 mol·L-1的溶液中:NH
)=0.1 mol·L-1的溶液中:NH![]() 、AlO
、AlO![]() 、Cl-、NO
、Cl-、NO![]()
D. 常温下,  =0.1 mol·L-1的溶液中:K+、NH3·H2O、SO
=0.1 mol·L-1的溶液中:K+、NH3·H2O、SO![]() 、NO
、NO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中正确的是
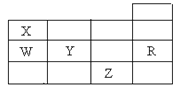
A. 常压下五种元素的单质中,Z单质的沸点最高
B. Y、Z的阴离子电子层结构都与R原子的相同
C. W的氢化物比X的氢化物稳定
D. Y元素最高价氧化物对应水化物比W元素的最高价氧化物对应水化物的酸性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是实验室制取氨气及氨气还原氧化铜实验。
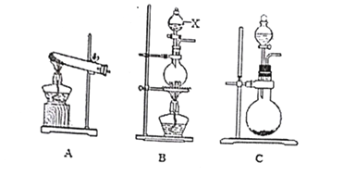
(1)实验用氢氧化钙与氯化铵制取氨气,其化学方程式为____________________________,应选用___(填序号)作为气体发生装置。B装置中仪器X的名称为______________。
(2)氨气与氧化铜反应原理为:3CuO+2NH3![]() 3Cu+N2+3H2O.实验小组利用如下图所示装置,检验纯氨气于氧化铜反应的部分产物。
3Cu+N2+3H2O.实验小组利用如下图所示装置,检验纯氨气于氧化铜反应的部分产物。
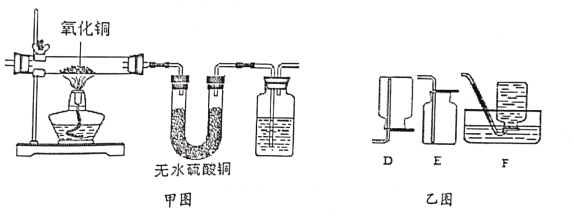
①甲图实验可以看到的实验现象是___________________________
②收集产物氮气时,选用乙图中的装置_________(填序号)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com