
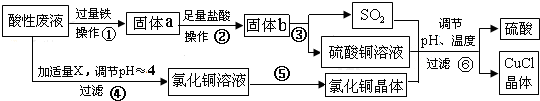
分析 从某酸性废液(主要含Cu2+、Fe3+、H+、Cl-)中制备氯化亚铜,向工业上以某酸性废液(含Cu2+、Fe3+、H+、Cl-)加入过量的铁粉,三价铁离子与铁粉反应转化为二价铁离子,铜离子与铁反应生成铜,然后过滤,滤渣为过量的铁和生成的铜,依据铜与铁活泼性,将滤渣溶于盐酸,铜与盐酸不反应,过滤得到滤渣即为铜,然后铜与浓硫酸反应生成硫酸铜和二氧化硫,酸性废液调节pH值使铁离子沉淀,过滤得氯化铜溶液,氯化铜、硫酸铜、二氧化硫反应生成氯化亚铜和硫酸,硫酸可以再循环利用,
(1)步骤①中铁能与铜离子及铁离子反应生成铜和亚铁离子等,同时铁也与酸性废液中的酸反应生成氢气;
(2)步骤②中从溶液中分离出固体物质过量的铁和生成的铜,据此答题;
(3)步骤④中为调节溶液的pH值,要能与酸反应同时不引入新的杂质,据此确定所加物质X;
(4)步骤⑤的操作是从氯化铜溶液中获得氯化铜晶体,要防止铜离子水解;
(5)CuCl微溶于水、不溶于乙醇及稀硫酸,所以要用乙醇洗涤CuCl晶体;
(6)根据流程分析可知,硫酸可以循环利用,根据反应中硫元素守恒判断是否需要补充硫酸;
(7)电解CuCl2溶液,阴极上是铜离子得电子生成亚铜离子,亚铜离子结合氯离子生成氯化亚铜沉淀.
解答 解:从某酸性废液(主要含Cu2+、Fe3+、H+、Cl-)中制备氯化亚铜,向工业上以某酸性废液(含Cu2+、Fe3+、H+、Cl-)加入过量的铁粉,三价铁离子与铁粉反应转化为二价铁离子,铜离子与铁反应生成铜,然后过滤,滤渣为过量的铁和生成的铜,依据铜与铁活泼性,将滤渣溶于盐酸,铜与盐酸不反应,过滤得到滤渣即为铜,然后铜与浓硫酸反应生成硫酸铜和二氧化硫,酸性废液调节pH值使铁离子沉淀,过滤得氯化铜溶液,氯化铜、硫酸铜、二氧化硫反应生成氯化亚铜和硫酸,硫酸可以再循环利用,
(1)步骤①中铁能与铜离子及铁离子反应生成铜和亚铁离子等,同时铁也与酸性废液中的酸反应生成氢气,涉及的离子方程式为Cu2++Fe=Cu+Fe2+、Fe+2Fe3+=3Fe2+、Fe+2H+=Fe2++H2↑,
故答案为:Cu2++Fe=Cu+Fe2+、Fe+2Fe3+=3Fe2+或Fe+2H+=Fe2++H2↑;
(2)步骤②中从溶液中分离出固体物质过量的铁和生成的铜,所以步骤②的操作名称是过滤、洗涤,
故答案为:过滤、洗涤;
(3)步骤④中为调节溶液的pH值,要能与酸反应同时不引入新的杂质,所以物质X为CuO或Cu (OH)2或CuCO3等,
故答案为:CuO或Cu (OH)2或CuCO3等;
(4)步骤⑤的操作是从氯化铜溶液中获得氯化铜晶体,要防止铜离子水解,所以步骤⑤的操作是在HCl气流中蒸发结晶,
故答案为:在HCl气流中蒸发结晶;
(5)CuCl微溶于水、不溶于乙醇及稀硫酸,所以要用乙醇洗涤CuCl晶体,减少CuCl的损失,
故答案为:减少CuCl的损失;
(6)根据流程分析可知,硫酸可以循环利用,Cu与浓硫酸反应生成CuSO4和 SO2的物质的量为1:1,而生产CuCl的过程中消耗CuSO4和SO2的物质的量也为1﹕1,所以理论上不需要补充H2SO4,
故答案为:硫酸;否;Cu与浓硫酸反应生成CuSO4和 SO2的物质的量为1:1,而生产CuCl的过程中消耗CuSO4和SO2的物质的量也为1﹕1,所以理论上不需要补充H2SO4;
(7)电解CuCl2溶液,阴极上是铜离子得电子生成亚铜离子,亚铜离子结合氯离子生成氯化亚铜沉淀,电极反应式为 Cu2++Cl-+e-=CuCl↓,
故答案为:Cu2++Cl-+e-=CuCl↓.
点评 本题考查了CuCl的生产工艺流程,为高考热点和难点,涉及物质的分离、物质的制备,明确物质的性质是解题关键,注意物质性质的理解应用,题目难度中等.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:填空题
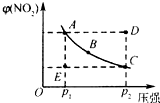 对于N2O4(g)?2NO2(g)在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点).
对于N2O4(g)?2NO2(g)在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,P元素属于ds区元素.
,P元素属于ds区元素.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
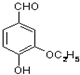 是食品添加剂的增香原料,其香味比香草醛更浓郁.
是食品添加剂的增香原料,其香味比香草醛更浓郁.
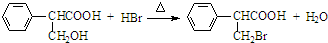 ,属于取代反应(填反应类型).
,属于取代反应(填反应类型). .
. .
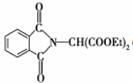
.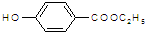 )是一种医药中间体,请设计合理方案用
)是一种医药中间体,请设计合理方案用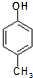 合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).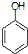 $\stackrel{CH_{3}I}{→}$
$\stackrel{CH_{3}I}{→}$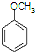 $\stackrel{HI}{→}$
$\stackrel{HI}{→}$
 $→_{催化剂}^{H_{2}△}$
$→_{催化剂}^{H_{2}△}$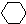 $→_{光照}^{Br_{2}}$
$→_{光照}^{Br_{2}}$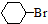
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
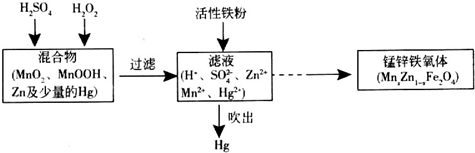
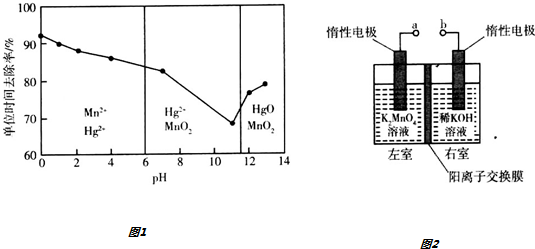
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
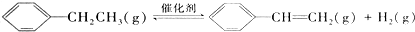
| 窗口编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
 | 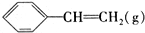 | H2(g) | ||
| 1 | 380 | 0.10 | 0.60 | 0.060 |
| 2 | 380 | 0.20 | ||
| 3 | 230 | 0.10 | 0.050 | 0.050 |
| A. | 该反应的正反应为放热反应 | |
| B. | 达到平衡时,容器I中的H2体积分数比容器Ⅱ中的小 | |
| C. | 容器I中反应达到平衡所需的时间比容器Ⅲ中的长 | |
| D. | 若起始时向容器Ⅲ中充入0.10mol (g)、0.10mol (g)、0.10mol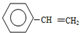 (g)和0.10mol H2,则反应向逆反应方向进行 (g)和0.10mol H2,则反应向逆反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.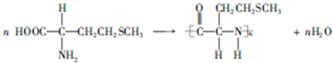 .
.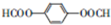 .
.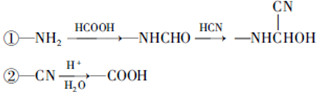
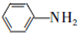 和HCOOH为原料制备化合物
和HCOOH为原料制备化合物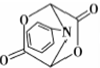 的流程如下:
的流程如下: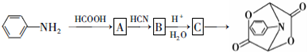
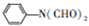 ,C
,C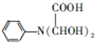 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com