
| A. | 检测时,电解质溶液中的H+向正极移动 | |
| B. | 若有0.4mol电子转移,则在标准状况下消耗2.24L氧气 | |
| C. | 电池反应的化学方程式为:CH3CH2OH+O2═CH3COOH+H2O | |
| D. | 正极上发生的反应为:O2+4e-+2H2O═4OH- |
分析 酸性乙醇燃料电池的负极反应为:CH3CH2OH-4e-+H2O═CH3COOH+4H+,正极应为O2得电子被还原,电极反应式为:O2+4e-+4H+═2H2O,正负极相加可得电池的总反应式为:CH3CH2OH+O2═CH3COOH+H2O,可根据电极反应式判断离子和电子的转移问题.
解答 解:A.原电池中,阳离子向正极移动,则电解质溶液中的H+向正极移动,故A正确;
B.氧气得电子被还原,化合价由0价降低到-2价,若有0.4mol电子转移,则应有0.1mol氧气被还原,在标准状况下的体积为2.24L,故B正确;
C.酸性乙醇燃料电池的负极反应为:CH3CH2OH-4e-+H2O═CH3COOH+4H+,可知乙醇被氧化生成乙酸和水,总反应式为:CH3CH2OH+O2═CH3COOH+H2O,故C正确;
D.酸性条件下,燃料电池中,氧气在正极得电子被还原生成水,正极反应式为:O2+4e-+4H+═2H2O,故D错误.
故选:D.
点评 本题考查酸性乙醇燃料电池的有关知识,题目难度中等,注意题中乙醇被氧化为乙酸的特点,答题中注意审题,根据题给信息解答.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 除去氯化钾中混有的KI:溶于水通入过量氯气,蒸发结晶 | |
| B. | 除去Na2CO3固体中混有的NaHCO3:加热至恒重 | |
| C. | 除去食盐中的泥沙:溶于水,过滤,滤液蒸发结晶 | |
| D. | 从溴水中提取溴单质:加入酒精萃取 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9.6g | B. | 6.4g | C. | 3.2g | D. | 1.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
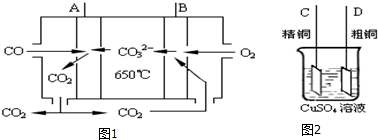
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2LO2所含的原子数为1.5NA | |
| B. | 常温常压下,18gH2O所含的原子数为NA | |
| C. | 标准状况下,16gO2所含的电子数为8NA | |
| D. | 标准状况下,11.2L氢气和氦气的混合气体所含的原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
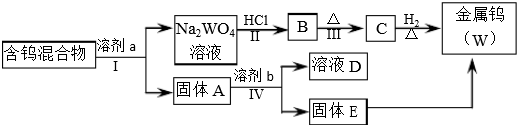
| 溶剂 | 煮沸时间(min) | W2O5(%) | WO3(%) | WO2 | 金属钨 |
| ①100g/L NaOH ②300g/LNa2CO3 ③50g/L Na2CO3 ④饱和Na2C2O4 ⑤饱和Na2C2O4(在CO2气氛下浸取) | 25 7 30 60 120 | 72.3 76.4 100 4.2 <0.5 | 100 100 100 100 100 | 未检出 | 未检出 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 A~D是原子序数在20以内的元素,其性质或结构信息如下表
A~D是原子序数在20以内的元素,其性质或结构信息如下表| 元素 | A | B | C | D | E |
| 性质或 结构 信息 | 其原子核内只有1个质子 | 其单质在空气中体积含量最多 | 地壳中含量最多的金属元素 | 其单质和化合物的焰色反应均为黄色 | 单质在常温、常压下是黄绿色气体 |
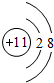 ,B原子的电子式:
,B原子的电子式: ,E离子的电子式:
,E离子的电子式: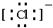 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
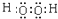 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com