
| A. | 1:2 | B. | 8:1 | C. | 1:4 | D. | 4:1 |
分析 根据电解原理:阳极离子的放电顺序:铜离子>氢离子,阴极离子的放电顺序:氢氧根离子>硫酸根离子,用惰性电极电解硫酸铜溶液,阴极上是铜离子得电子,阳极上是氢氧根离子失电子,电解硫酸铜阶段,当铜离子电解完毕后,阳极上是氢氧根离子失电子,阴极上是氢离子在得电子,电解的最后是电解水,所以可能发生反应2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4、2H2O$\frac{\underline{\;电解\;}}{\;}$O2↑+2H2↑,结合电子守恒分析即可解答.
解答 解:用铂电极电解CuSO4溶液,开始阶段:阴极电极反应:Cu2++2e-=Cu,阳极电极反应:4OH--4e-=2H2O+O2↑,阴阳两极转移电子数相等,假设转移电子是4mol,在阳极和阴极上析出物质的质量比是32:2×64=1:4,C符合,
当铜离子电解完毕后,阳极上是氢氧根离子失电子,阴极上是氢离子在得电子,电解的最后是电解水,阴极电极反应:2H++2e-=H2↑,阳极电极反应:4OH--4e-=2H2O+O2↑,↑阴阳两极转移电子数相等,假设转移电子是4mol,在阳极和阴极上析出物质的质量比是32:2×2=8:1,B符合,
故选BC.
点评 本题是对电解原理的考查,要求熟练应用离子的放电顺序,注意电解硫酸铜溶液的最后是电解水,题目难度中等,电解硫酸铜为两个阶段为易错点.


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H10 的烯烃 | B. | 分子式为C4H8O2 的酯 | ||
| C. | 甲苯(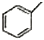 )的一氯代物 )的一氯代物 | D. | 立体烷(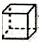 )的二氯代物 )的二氯代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,a个-CH 3,其余为-OH,则该物质分子中-OH的个数可能为( )
,a个-CH 3,其余为-OH,则该物质分子中-OH的个数可能为( )| A. | m-a | B. | n+m+a | C. | m+1-a | D. | m-1-a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在任何温度下都能自发进行 | B. | 在任何温度下都不能自发进行 | ||
| C. | 仅在高温下自发进行 | D. | 仅在低温下自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去KCl溶液中的少量K2CO3:加入适量的盐酸 | |
| B. | 除去CO2中的少量HCl:通入NaOH溶液 | |
| C. | 除去NaCl溶液中的少量MgCl2:加入适量KOH溶液,过滤 | |
| D. | 除去N2中的少量O2:通过灼热的CuO粉末 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐可以作为调味剂,也可以调节体液电解质平衡 | |
| B. | 食品保鲜膜、塑料水杯等生活用品的主要成分是聚乙烯 | |
| C. | 化工生产中煤的干馏、石油的分馏、天然气生产甲醇均属于化学变化 | |
| D. | 高铁车厢材料大部分采用铝合金,因为铝合金强度大、质量轻、抗腐蚀能力强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题





 .
. .
. .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com