
 碘被称为“智力元素”,科学合理地补充碘可防治碘缺乏病,KI、KIO3曾先后用于加碘盐中.
碘被称为“智力元素”,科学合理地补充碘可防治碘缺乏病,KI、KIO3曾先后用于加碘盐中.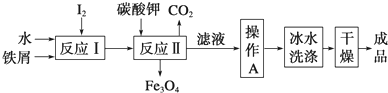
分析 (1)①.铁元素与碘元素的质量比为21:127,铁、碘原子个数比为3:8,反应Ⅰ生成了Fe3I8,反应Ⅱ是Fe3I8和碳酸钾反应生成四氧化三铁、二氧化碳与KI;
②.操作A是从溶液中获得KI晶体;用冰水洗涤,洗涤除去表面可溶性杂质,同时减少KI的溶解损失;
(2)①.碘酸钾热稳定性差,加热容易分解;
②.氧化时发生反应:5H2O2+I2=2HIO3+4H2O,可得关系式为:2KIO3~5H2O2,根据关系式计算;
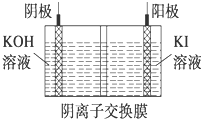
③.电解时,阳极发生氧化反应,碘离子失去电子变成碘酸根离子,阴极发生还原反应,水中的氢离子得到电子生成氢气,同时有碱生成,电解结束后阴极区的pH增大.
解答 解:(1)①.铁元素与碘元素的质量比为21:127,铁、碘原子个数比为$\frac{21}{56}$:$\frac{127}{127}$=3:8,反应Ⅰ生成了Fe3I8,反应Ⅱ是Fe3I8和碳酸钾反应生成四氧化三铁、二氧化碳与KI,反应Ⅱ的反应方程式是:Fe3I8+4K2CO3=Fe3O4+8KI+4CO2↑;
故答案是:Fe3I8+4K2CO3=Fe3O4+8KI+4CO2↑;
②.反应Ⅱ的滤液需要经过加热浓缩、冷却结晶、过滤,初步得到碘化钾;由于碘化钾混有可溶性杂质,需要经过洗涤才能得到较纯净的产品,故用冰水洗涤,洗涤除去表面可溶性杂质,同时减少KI的溶解损失,
故答案是:加热浓缩、冷却结晶、过滤; 洗涤除去表面可溶性杂质,同时减少KI的溶解损失;
(2)①.由于碘酸钾的热稳定性较差,在较高温度下K1O3易分解,烹饪时含KIO3的食盐常在出锅前加入,
故答案是:在较高温度下K1O3易分解;
②.氧化时发生反应:5H2O2+I2=2HIO3+4H2O,
设需要质量分数为30%的双氧水x kg,则:
2KIO3~~~~~5H2O2
2×214 170
1284kg xkg×30%
所以2×214:170=1284kg:xkg×30%
解得x=1700
故答案为:1700;
③.电解时,阳极发生氧化反应,碘离子失去电子变成碘酸根离子,阳极电极反应式为:I-+6OH-+6e-═IO3-+3H2O,阴极发生还原反应,水中的氢离子得到电子生成氢气,同时有碱生成,阴极有气泡生成,电解结束后阴极区的pH增大,
故答案是:I-+3H2O═IO3-+3H2↑;有气泡产生;增大.
点评 本题考查物质的制备,涉及物质分离提纯、氧化还原反应、电解原理应用,注意掌握实验基本操作,注重学生知识的迁移应用能力的考查,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学小组进行Na2SO3的性质实验探究.
某化学小组进行Na2SO3的性质实验探究.| 编号 | 实验现象 |
| a | 溴水褪色 |
| b | 产生淡黄色沉淀 |
| c | 滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去 |
| n(SO${\;}_{3}^{2-}$ ):n(HSO${\;}_{3}^{-}$) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +(2n-1)H2O.
+(2n-1)H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,0.1mol/LNa2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | 0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:C(Na+)>c(CO32-)>c(HCO3- )>c(OH-)>c(H+) | |
| C. | pH相同的①CH3 COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③ | |
| D. | 向0.1mol•L-1的氨水中加入少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
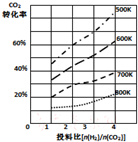 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com