
分析 在氢氟酸溶液中,存在如下电离平衡:HF?H++F-,升高温度、加水稀释促进弱电解质电离,向弱电解质溶液中加入和氢离子或氟离子反应的物质促进氢氟酸电离,加入含有氢离子或氟离子的物质抑制氢氟酸电离.
解答 解:(1)加入氢氧化钠固体,氢氧化钠和氢离子反应生成水,促进氢氟酸电离,溶液中氢离子浓度减小,
故答案为:正;减小;
(2)向溶液中加入氟化钠固体,氟离子浓度增大,抑制氢氟酸电离,平衡向逆反应方向移动,溶液中氢离子浓度减小,
故答案为:逆;减小;
(3)弱电解质存在电离平衡,加水稀释促进电离,电离平衡正向进行,但平衡状态各微粒的浓度减小,
故答案为:正,减小;
点评 本题考查了弱电解质的电离,明确影响弱电解质电离的因素是解本题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 水结成冰体积膨胀,密度变小 | |
| B. | 水加热到很高的温度都难以分解 | |
| C. | HF、HCl、HBr、HI的热稳定性依次减弱 | |
| D. | CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
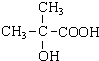 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>C>D | B. | A>C>B>D | C. | A>C>D>B | D. | B>D>C>A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在粗硅的制取中发生反应2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si,所以非金属性C>Si | |
| B. | 由Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CO2↑+Na2SiO3可知硅酸的酸性大于碳酸 | |
| C. | 用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2 | |
| D. | 由H2S+CuSO4═CuS↓+H2SO4可知,氢硫酸的酸性比硫酸强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
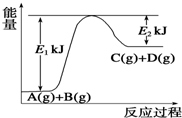 已知某反应A(g)+B(g)?C(g)+D(g),过程中的能量变化如图所示,回答下列问题.
已知某反应A(g)+B(g)?C(g)+D(g),过程中的能量变化如图所示,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当c(Cu2+)=c(Mn2+)时该反应达到平衡 | |
| B. | 从该反应原理可以得出CuS的溶解度比MnS的溶解度大 | |
| C. | 该反应的平衡常数K=$\frac{{K}_{sp}(MnS)}{{K}_{sp}(CuS)}$ | |
| D. | 往平衡体系中加入少量CuSO4(s)后,c( Mn2+)不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com