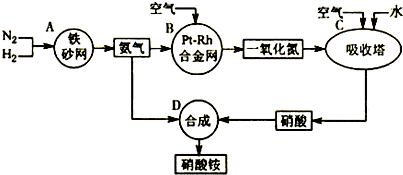
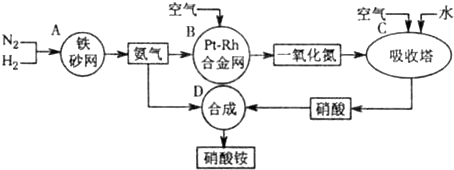
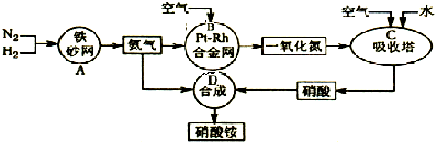
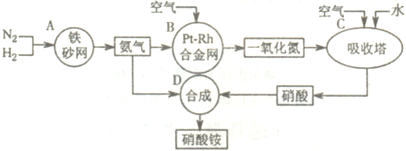
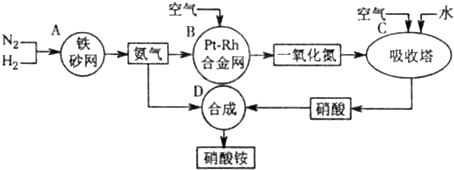
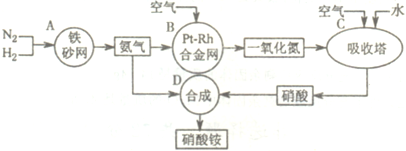
解:(1)吸收塔中涉及的反应有:2NO+O
2═2NO
2;3NO
2+H
2O═2HNO
3+NO;4NO
2+O
2+H
2O═4HNO
3;为使NO充分氧化而生成硝酸,应通入过量空气;题中涉及的化学反应有:
①N
2+3H
2?2NH
3②4NH
3+5O
2
4NO+6H
2O③2NO+O
2═2NO
2④3NO
2+H
2O═2HNO
3+NO⑤4NO
2+O
2+H
2O═4HNO
3⑥NH
3+HNO
3═NH
4NO
3,
其中①②③④⑤属于氧化还原反应,即ABC属于氧化还原反应,故答案为:ABC;
(2)已知:①4NH
3(g)+3O
2(g)═2N
2(g)+6H
2O(g)△H=-1266.8kJ/mol,
②N
2(g)+O
2(g)═2NO(g)△H=+180.5kJ/mol,
利用盖斯定律①-2×②可得:4NH
3(g)+5O
2(g)

4NO(g)+6H
2O(g);△H=-905.8KJ/mol;
化学平衡常数表达式为
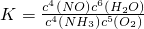
,
故答案为:4NH
3(g)+5O
2(g)

4NO(g)+6H
2O(g)△H=-905.8KJ/mol;
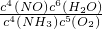
;
(3)为提高氢气的转化率,应是反应向正反应方向移动,则可采取的措施有:增大压强、循环利用和不断补充氮气、及时分离出氨气;故答案为:CDE;
(4)设反应起始时H
2和N
2的物质的量分别为3mol和1mol,平衡时转化了xmolN
2,
N
2 +3H
2 ?2NH
3起始 1mol 3mol 0
转化 x 3x 2x
平衡 1-x 3-3x 2x
根据题意知:

=17.6%,则x=0.299,
所以此时H
2的转化率为
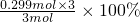
=29.9%,故答案为:29.9%
分析:本题中涉及的化学反应有:①N
2+3H
2?2NH
3②4NH
3+5O
2
4NO+6H
2O③2NO+O
2═2NO
2④3NO
2+H
2O═2HNO
3+NO⑤4NO
2+O
2+H
2O═4HNO
3⑥NH
3+HNO
3═NH
4NO
3;
(1)吸收塔中涉及的反应有:2NO+O
2═2NO
2;3NO
2+H
2O═2HNO
3+NO;4NO
2+O
2+H
2O═4HNO
3;为使NO充分氧化而生成硝酸,应通入过量空气;根据反应中各物质的组成元素的化合价是否发生变化来判断是否发生氧化还原反应;
(2)已知:①4NH
3(g)+3O
2(g)═2N
2(g)+6H
2O(g);△H=-1266.8kJ/mol;
②N
2(g)+O
2(g)═2NO(g);△H=+180.5kJ/mol,利用盖斯定律可求知反应热;根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积计算;
(3)为提高某一反应物的转化率,应使平衡向正反应反应方向移动;
(4)根据阿伏加德罗定律结合化学方程式,用三段式计算法计算.
点评:本题以工业合成硝酸铵为载体考查化学反应与能量、化学平衡等问题,题目难度中等,注意外界条件对化学平衡的影响,注意有关化学平衡的计算方法.

 4NO+6H2O③2NO+O2═2NO2④3NO2+H2O═2HNO3+NO⑤4NO2+O2+H2O═4HNO3⑥NH3+HNO3═NH4NO3,
4NO+6H2O③2NO+O2═2NO2④3NO2+H2O═2HNO3+NO⑤4NO2+O2+H2O═4HNO3⑥NH3+HNO3═NH4NO3, 4NO(g)+6H2O(g);△H=-905.8KJ/mol;
4NO(g)+6H2O(g);△H=-905.8KJ/mol;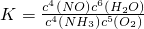 ,
, 4NO(g)+6H2O(g)△H=-905.8KJ/mol;
4NO(g)+6H2O(g)△H=-905.8KJ/mol; 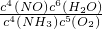 ;
; =17.6%,则x=0.299,
=17.6%,则x=0.299,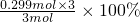 =29.9%,故答案为:29.9%
=29.9%,故答案为:29.9% 4NO+6H2O③2NO+O2═2NO2④3NO2+H2O═2HNO3+NO⑤4NO2+O2+H2O═4HNO3⑥NH3+HNO3═NH4NO3;
4NO+6H2O③2NO+O2═2NO2④3NO2+H2O═2HNO3+NO⑤4NO2+O2+H2O═4HNO3⑥NH3+HNO3═NH4NO3;

 全能测控一本好卷系列答案
全能测控一本好卷系列答案