
| A. | HCO3-+H2O?H3O++CO32- | B. | HS-+H2O?H2S+OH- | ||
| C. | Fe3++3H2O?Fe(OH)3↓+3H+ | D. | Br-+H2O?HBr+OH- |
分析 水解反应的实质是:弱酸或弱碱离子结合水电离出的氢离子或氢氧根离子生成弱电解质的过程,水解反应方程式用可逆符号表示,以此分析得出正确结论.
解答 解:A.HCO3-+H2O?H3O++CO32-,是碳酸氢根离子的电离方程式,不是水解离子方程式,故A错误;
B.HS-+H2O?H2S+OH-,是硫氢根离子的水解离子方程式,故B正确;
C.水解程度较小,Fe(OH)3不能加沉淀符号,离子方程式:Fe3++3H2O?Fe(OH)3+3H+,故C错误;
D.HBr是强酸,Br-不能发生水解反应,故D错误;
故选B.
点评 本题考查学生对水解反应原理的理解,题目难度不大,明确水解的反应原理是解答本题的关键,注意区分反应、水解和电离.


科目:高中化学 来源: 题型:多选题
| A. | 氰的分子式为(CN)2,分子中含有3个σ键和4个π键 | |
| B. | 甲醇(CH3OH)分子内的O-C-H键角小于甲醛(HCHO)分子内的O-C-H键角 | |
| C. | 第二周期基态原子未成对电子数与Ni相同且第一电离能最小的元素是氧 | |
| D. | 二氧化硅晶体中最小的环有3个硅原子、3个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
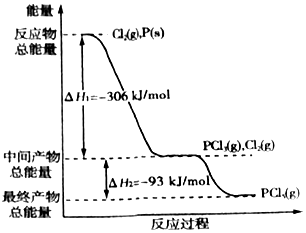 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
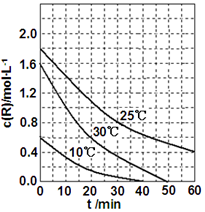 为研究某溶液中溶质R的分解速率的影响因素,分别用三份不同初始浓度的R溶液在不同温度下进行实验,c(R)随时间变化如图.下列说法不正确的是( )
为研究某溶液中溶质R的分解速率的影响因素,分别用三份不同初始浓度的R溶液在不同温度下进行实验,c(R)随时间变化如图.下列说法不正确的是( )| A. | 25℃时,在10~30min内,R 的分解平均速率为0.030 mol•L-1•min-1 | |
| B. | 对比30℃和10℃曲线,在50min时,R的分解百分率相等 | |
| C. | 对比30℃和25℃曲线,在0~50min内,能说明R的分解平均速率随温度升高而增大 | |
| D. | 对比30℃和10℃曲线,在同一时刻,能说明R的分解速率随温度升高而增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在一密闭容器中发生反应N2(g)+3H2(g)?2NH3(g)△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
在一密闭容器中发生反应N2(g)+3H2(g)?2NH3(g)△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
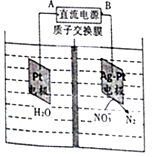
| A. | A极为负极,电子从铂电极流向该极 | |
| B. | Pt电极上发生还原反应 | |
| C. | Ag-Pt电极发生的反应是:2NO3-+6H2O+10e-═N2↑+12OH- | |
| D. | 电解一段时间后,两地减少的质量一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热方能发生的反应一定是吸热反应 | |
| B. | 放热的反应在常温下一定很容易发生 | |
| C. | 吸热反应在需要在加热条件下才能发生 | |
| D. | 反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合溶液中由水电离出的c(H+)=1×10-5mol/L | |
| B. | c(A-)+c(HA)=2c (Na+)=0.4 mol/L | |
| C. | HA溶液中$\frac{c({A}^{-})}{c(HA)•c(O{H}^{-})}$与上述混合溶液中$\frac{c({A}^{-})}{c(HA)•c(O{H}^{-})}$相等 | |
| D. | c(A-)-c(HA)=2 c (H+)-c (OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
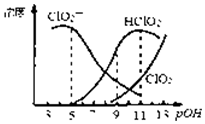 亚氯酸钠(NaClO2)用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成ClO2、HClO2、ClO2-、Cl- 等,其中HClO2和ClO2都具有漂白作用.已知POH=-lgc(OH-),经测定25℃时各组分含量随POH变化情况如图所示(Cl-没有画出),此温度下,下列分析错误的是( )
亚氯酸钠(NaClO2)用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成ClO2、HClO2、ClO2-、Cl- 等,其中HClO2和ClO2都具有漂白作用.已知POH=-lgc(OH-),经测定25℃时各组分含量随POH变化情况如图所示(Cl-没有画出),此温度下,下列分析错误的是( )| A. | 亚氯酸钠在碱性条件下较稳定 | |
| B. | PH=7时,溶液中含氯微粒的浓度大小:c(ClO2-)>c(HClO2)>c (ClO2) | |
| C. | HClO2的电离平衡常数的数值Ka=10-6 | |
| D. | 同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有2c(HClO2)+c(H+)=2c(ClO2-)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com