
【题目】3He可以作为核聚变材料,以下关于3He的说法正确的是
A.比4He少一个质子B.比4He多一个中子
C.是4He的同素异形体D.是4He的同位素
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】为满足不同的需要,人们应用原电池原理制作了多种电池。
(1)有人以化学反应2Zn+O2+4H+=2Zn2++2H2O为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作,则该原电池负极的电极反应为___________。
(2)FeCl3溶液常用于腐蚀印刷电路铜板,其反应的离子方程式为________________;若将此反应设计或原电池,则负极所用电极材料为___________,正极反应为_________________。
(3)美国阿波罗宇宙飞船上使用了一种新型发电装置—氢氧燃料电池,其构造如图所示,其中A、B两个电极均由多孔的碳炔组成,该电池的正极反应式为_________________,若该电池工作时溶液中增加1molH2O,则理论上电路中通过电子的物质的量为_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)50 mL 0.50 mol·L-1的盐酸与50 mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,完成下列问题: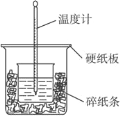
(1)从实验装置上看,图中尚缺少的一种玻璃用品是_____________。请指出装置中的另外错误是 ________________________
(2)烧杯间填满碎纸条的作用是___________。
(3)大烧杯上如不盖硬纸板,求得的中和热值___________(填“偏大”“偏小”“无影响”)。
(4)实验中改用60 mL 0.50mol·L-1的盐酸跟60 mL 0.55mol·L-1NaOH溶液进行上述实验相比,所放出的热量___________(填“相等”“不相等”),所求中和热___________(填“相等”“不相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、量筒、泡沫塑料、泡沫塑料板、胶头滴管、0.5 mol·L-1盐酸、0.55 mol·L-1NaOH溶液,实验尚缺少的玻璃用品是______、_______________。他们记录的实验数据如下:
实验用品 | 溶液温度 | 中和热 | |||
t1 | t2 | ΔH | |||
① | 50 mL0.55 mol·L-1NaOH溶液 | 50 mL0.5mol·L-1HCl溶液 | 20 ℃ | 23.3 ℃ | |
② | 50 mL0.55 mol·L-1NaOH溶液 | 50 mL0.5 mol·L-1 HCl溶液 | 20 ℃ | 23.5 ℃ | |
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。
(2)NaOH用量比HCl用量稍多的原因是_________________________________。
(3)根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: ___________________。
(4)若用KOH代替NaOH,对测定结果________(填“有”或 “无”)影响;若用醋酸代替HCl做实验,对测定结果__________(填“有”或“无”)影响。
(5)两溶液混合后,怎样搅拌溶液_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示,是原电池的装置图。请回答:
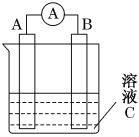
若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且作负极,则A电极上发生的电极反应式为______;电子的移动方向是______________;反应进行一段时间后溶液C的氢离子浓度将________(填“升高”、“降低”或“基本不变”)。
(2)下图是一个双液原电池装置图,下列说法正确的是__________。
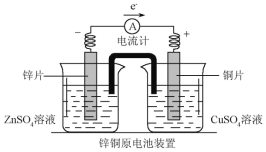
A.盐桥中的阴离子向CuSO4溶液中移动 B.盐桥的作用之一是平衡电荷
C.铜片作电池的负极 D.该电池比单液原电池的电流更稳定
(3)甲醇是重要的化工原料,又可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:
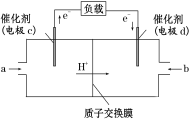
电池总反应为2CH3OH+3O2===2CO2+4H2O,则C电极是________(填“正极”或“负极”),C电极的反应方程式为_______________;若线路中转移3 mol电子,则上述CH3OH燃料电池,消耗的CH3OH的质量为_____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式____________。
②由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是_____________。
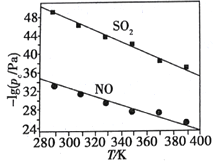
(2)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pc如图所示。
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均_______(填“增大”“不变”或“减小”)。
②反应ClO2+2SO32===2SO42+Cl的平衡常数K表达式为________________。
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是______________。
②已知下列反应:
SO2(g)+2OH (aq) =SO32 (aq)+H2O(l) ΔH1
ClO (aq)+SO32 (aq) =SO42 (aq)+Cl (aq) ΔH2
CaSO4(s) ===Ca2+(aq)+SO42(aq) ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO (aq) +2OH (aq) === CaSO4(s) +H2O(l) +Cl (aq)的ΔH=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有①168 O 、 17 8O 、 188O ;②H2、D2、T2;③石墨、金刚石;④11H 、21H、 31H;四组微粒或物质。互为同位素的是_____(填编号)。
(2)下列物质中:①N2;②MgCl2;③NH4Cl;④CH4;⑤CO2;⑥Ne;⑦H2S;⑧KOH;⑨Na2O2; ⑩K2O;只存在共价键的是_____;属于离子化合物,但含有共价键的 是_____。
(3) 用电子式表示下列物质:
MgCl2 _____; N2 _____;
NH4+_____; Na2O2 _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作合理的是
A.用10mL量筒量取7.50mL稀盐酸
B.用25mL碱式滴定管量取14.80mLNaOH溶液
C.用广泛pH试纸测得某碱溶液的pH为12.7
D.用托盘天平称取25.20gNaCl固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com