
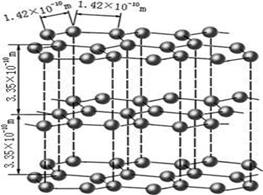
| A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4 |
| B.硬度由大到小:金刚石>碳化硅>晶体硅 |
| C.熔点由高到低:Na>Mg>Al |
| D.晶格能由大到小:NaF> NaCl> NaBr>NaI |

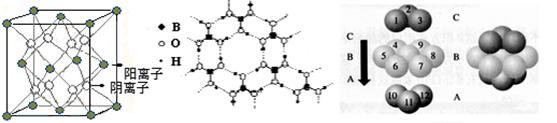
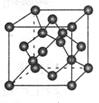
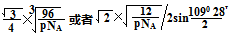 (2分)
(2分)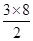 =12,由图III中未标号的G原子形成晶体后周围最紧邻的G原子数为3+6+3=12,故答案为:12;12;
=12,由图III中未标号的G原子形成晶体后周围最紧邻的G原子数为3+6+3=12,故答案为:12;12;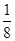 +面心6个×
+面心6个×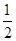 +体心3个×1=8个
+体心3个×1=8个 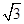 /4.
/4. 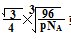


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.熔点1 070 ℃,易溶于水,水溶液能导电 |
| B.熔点10.31 ℃,液态不导电,水溶液导电 |
| C.难溶于CS2,熔点1 128 ℃,沸点4 446 ℃ |
| D.熔点97.81 ℃,质软导电,密度0.97 g·cm-3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
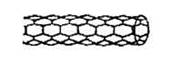
| A.纳米碳管是一种无机化合物 |
| B.纳米碳管中碳原子间以共价键结合 |
| C.纳米碳管与石墨互为同位素 |
| D.0.12g纳米碳管中含有6.02×l022个碳原子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.金属离子之间的相互作用 | B.金属原子之间的作用 |
| C.金属离子与自由电子间的相互作用 | D.金属原子与自由电子间的相互作用 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SiO2、NaCl、I2、Br2 | B.SiO2、NaCl、Br2、I2 |
| C.NaCl、SiO2、I2、Br2 | D.Br2、I2、NaCl、SiO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.18g冰晶体中含有的氢键数为4NA |
| B.30g SiO2晶体中含Si–O键数为NA |
| C.78g Na2O2晶体中含有阴阳离子总数为4NA |
| D.62g白磷晶体中含P–P键数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com