
 �������������Ű�ҹ��ֵ���������SO2����ɿ�������Ⱦ����Ҫԭ�������Ƽ�ѭ�����ɳ�ȥSO2��
�������������Ű�ҹ��ֵ���������SO2����ɿ�������Ⱦ����Ҫԭ�������Ƽ�ѭ�����ɳ�ȥSO2��| O | 2- 3 |
| O | - 3 |
| O | - 3 |
| O | 2- 3 |
N��SO
|
91��9 | 1��1 | 1��91 | ||||
| pH | 8.2 | 7.2 | 6.2 |
2- 3 |
- 3 |
- 3 |
2- 3 |
2- 3 |
2- 3 |
- 3 |


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��ɽ��ʡ��У�����ڶ���������ѧ�Ծ��������棩 ���ͣ������
(8��)������������ֿ�ʼ��Ű�ҹ��ֵ���������SO2����ɿ�����Ⱦ����Ҫԭ�������Ƽ�ѭ�����ɳ�ȥSO2��
��1���Ƽ�ѭ�����У�����ҺΪNa2SO3��Һ�������շ�Ӧ�����ӷ���ʽ��
��2����֪H2SO3�ĵ��볣��Ϊ K1��1��54��10-2 , K2��1��02��10-7, H2CO3�ĵ��볣��Ϊ K1��4��30��10-7, K2�� 5��60��10-11,�����������Թ������_____________��
A��CO32- HSO3�� B��HCO3�� HSO3��
C��SO32- HCO3�� D��H2SO3 HCO3��
��3������Һ����SO2�Ĺ����У�pH��n(SO3²��):n(HSO3��)�仯��ϵ���±�:
|
n(SO3²��):n(HSO3��) |
91 ��9 |
1 ��1 |
1 ��91 |
|
pH |
8��2 |
7��2 |
6��2 |
���ϱ��ж�NaHSO3��Һ���������������ԣ���ԭ���ĽǶȽ���ԭ��������������������������
����NaHSO3��Һ������Ũ�ȹ�ϵ����ȷ����(ѡ����ĸ):������������������������
A����Na����= 2c��SO32-���� c��HSO3������
B����Na����> c��HSO3����> c��H����> c��SO32-��> c��OH����,
C����H2SO3��+ c��H����= c��SO32-��+ ��OH����,
D����Na����+ c��H����= 2 c��SO32-��+ c��HSO3����+ c��OH����
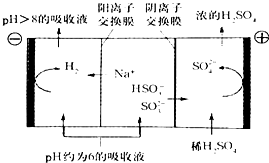
��4��������Һ��pH����ԼΪ6ʱ���������������� ������ʾ��ͼ����:

�� ����Һ���������е��ܷ�Ӧ����ʽ����������������������������������
�� ���缫����1mol����ת��ʱ��������Ϊ�������������ˣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��ɽ��ʡ̩���и�����ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
�������������Ű�ҹ��ֵ���������SO2����ɿ�������Ⱦ����Ҫԭ�������Ƽ�ѭ�����ɳ�ȥSO2��
��1���Ƽ�ѭ�����У�����ҺΪNa2SO3��Һ���÷�Ӧ�����ӷ���ʽ��________��
��2����֪H2SO3�ĵ��볣��ΪK1��1.54��10��2��K2��1.024��10��7��H2CO3�ĵ��볣��ΪK1��4.30��10��7��K2��5.60��10��11�������������Դ����������______������ţ���
A.CO32�� HSO3�� B. HCO3�� HSO3�� C. SO32�� HCO3�� D. H2SO3 HCO3��
��3������Һ����SO2�Ĺ����У�pH��n(SO32��):n(HSO3��)�仯��ϵ���±���
|
n(SO32��):n(HSO3��) |
91:9 |
1:1 |
1:91 |
|
pH |
8.2 |
7.2 |
6.2 |
�ٸ����ϱ��ж�NaHSO3��Һ��_______�ԣ��Խ���ԭ��__________________________��
����NaHSO3��Һ������Ũ�ȹ�ϵ����ȷ����_______������ţ���
A��c(Na+)��2c(SO32-)+c(HSO3-)
B��c(Na+)��c(HSO3-)��c(H+)��c(SO32-)��c(OH-)
C��c(H2SO3)+ c(H+)��c(SO32-)+c(OH-)
D��c(Na+)+ c(H+)��2c(SO32-)+ c(HSO3-)+ c(OH-)
��4��������Һ��pH����ԼΪ6ʱ�����������۴�����ֱ���õ�pH��8������Һ��ѭ�����ã����ʾ��ͼ���£�

��д�������Ϸ����ĵ缫��Ӧʽ____________��
�ڵ��缫����1mol����ת��ʱ�������������Ϊ__________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com