
下列反应中的氨与反应4NH3 + 5O2 → 4NO + 6H2O中的氨作用相同的是 ( )
A.2Na + 2NH3 → 2NaNH2 + H2↑ B.NH3 + HNO3→ NH4NO3
C.4NH3 + 6NO → 5N2 + 6H2O D.3SiH4 + 4NH3 → Si3N4 + 12H2
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
将一定量的氯气通入300ml浓度为1mol/L的浓NaOH溶液中恰好完全反应,加热少许时间后溶液中形成NaCl、NaClO及NaClO3的共存体系。下列判断不正确的是
A.n(Na+):n(C1—)可能为7:3
B.n(NaCl):n(NaClO):n(NaClO3)可能为11:1:2
C.参加反应氯气物质的量为0.15mol
D.反应中转移电子物质的量n的范围:0.15mol < n < 0.25mol
查看答案和解析>>
科目:高中化学 来源: 题型:
非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成:

⑴非诺洛芬中的含氧官能团为 和 (填名称)。
⑵反应①中加入的试剂X的分子式为C8H8O2,X的结构简式为 。
⑶在上述五步反应中,其中②的反应类型是: ;④的反应类型是: 。
⑷B的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.分子中有6种不同化学环境的氢,且分子中含有两个苯环。
写出该同分异构体的结构简式 。
⑸根据已有知识并结合相关信息,写出以 为原料制备
为原料制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:

合成路线流程图:
。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关性质的比较,不能用元素周期律解释的是 ( )
A、酸性:H2SO4>H3PO4 B、非金属性:Cl>Br
C、碱性:NaOH>Mg(OH)2 D、热稳定性:Na2CO3>NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液,加热后颜色一定变浅的是 ( )
A、稀氨水和酚酞溶液 B、滴有酚酞的Na2CO3溶液
C、滴有酚酞的氢氧化钙溶液 D、溶有SO2的品红溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
已知适当条件下+7、+6、+4价锰的化合物都能和浓盐酸反应制得氯气且还原产物都是MnCl2。将6.32g KMnO4粉末加热一段时间后收集到0.112L气体(标准状况,后同),冷却后放入足量的浓盐酸再加热,又收集到VL黄绿色气体,下列说法正确的是 ( )
A.V=2.24L
B.参加反应的HCl为0.18mol
C.无法确定最终生成含钾化合物的数量是多少
D.6.32g KMnO4粉末若直接与足量浓盐酸反应可得到2.24L Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作中,正确的是
A、配制5%NaCl溶液时,将称量的NaCl放入烧杯中加计量的水搅拌溶解
B、配制1mol·L-1NaOH溶液时,将溶解后的NaOH溶液立即注入容量瓶
C、配制0.1mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释
D、取用一小块钠时,将剩余的钠丢进废液缸
查看答案和解析>>
科目:高中化学 来源: 题型:
氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。请你根据所学知识回答下列问题:
Ⅰ.把氯气通入紫色石蕊溶液中,可以观察到的现象是: 。
请你解释其中的原因________________________________________________
Ⅱ.某化学兴趣小组计划用氯气和氢氧化钠制取简易消毒液。
(1) 其反应原理为:(用化学方程式表示)____ ____________________________________。
(2)实验室配制好4.0 mol·L-1的NaOH溶液,这种溶液________ L才能与2.24 L氯气(标准状况)恰好完全反应。[Z
(3)配制500 mL 4.0 mol·L-1 NaOH溶液的实验步骤:
a.计算需要氢氧化钠固体的质量。
b.称量氢氧化钠固体。
c.将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入容量瓶。
d.用适量蒸馏水溶解称量好的氢氧化钠固体,冷却。
e.盖好瓶塞,反复上下颠倒,摇匀。
f.继续向容量瓶中加蒸馏水至刻度线下1 cm~2 cm时,改用胶头滴管加蒸馏水至凹液面与刻度线相切。
①所需称量的氢氧化钠固体的质量是_________ 。
②上述步骤的正确操作顺序是
____________________________________。
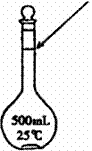 ③上述实验需要的仪器有
③上述实验需要的仪器有
_________________________________________________________ 。
④某同学观察液面的情况如图所示,对所配溶液的物质的量浓度有何影响? _______________(填“偏高”、“偏低”或“无影响”);
⑤在配制溶液的过程中,下列操作能造成结果偏低的是___________。
A.容量瓶不干燥,含有少量蒸馏水 B.溶解所用烧杯未洗涤
C.NaOH溶解后,未冷却即进行实验 D.定容后摇匀,发现液面低于刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
电解法是处理工业废水的一种重要方法。如酸性含(Cr2O72-)废水就可以采用电解法进行无害化处理。电解时采用Fe作阳极,惰性电极作阴极。已知:①氧化性:Cr2O72->Fe3+ ;②Cr2O72-被还原生成Cr3+;③Ksp[Cr (OH)3]=6.3×10-31。下列说法正确的是( )
A. 阳极材料也可以是Cu
B. 阴极每产生3molH2,则有1mol Cr2O72-被还原
C. 一段时间后溶液中发生反应Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
D. 电解最后阶段需要加碱,使溶液中的阳离子转化为沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com