
分析 发生2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,固体质量减少(a-b)g,结合差量法计算.
解答 解:设分解的NaHCO3的质量为x,则
①2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O△m
168 62
x (a-b)g
$\frac{168}{x}=\frac{62}{(a-b)}$,解得x=$\frac{84(a-b)}{31}$
m剩(NaHCO3)=a-$\frac{84(a-b)}{31}$=$\frac{84b-53a}{31}$,
故答案为:$\frac{84b-53a}{31}$;
②2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O△m
106 62
m (a-b)g
$\frac{106}{m}=\frac{62}{(a-b)}$,解得m=$\frac{53}{31}$ (a-b),
故答案为:$\frac{53}{31}$ (a-b);
③2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O
168 106
a $\frac{106a}{168}$
即 $\frac{106a}{168}$=b,则b=$\frac{53a}{84}$,
故答案为:$\frac{53a}{84}$.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应及质量关系为解答的关键,侧重分析与计算能力的考查,注意差量法的应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
| 实验 | 操作 | 现象 |
| I | 常温下将MnO2和12mol•L-1浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
| II | 将 I中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
| III | 加热MnO2和4mol•L-1稀盐酸混合物 | 无明显现象 |
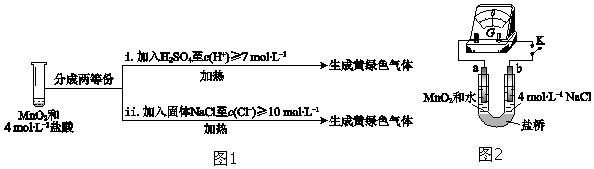
| 实验 | 操作 | 现象 |
| I | 将湿润的淀粉KI试纸伸入棕黄色气体中 | 试纸先变蓝,后褪色 |
| II | 将湿润的淀粉KI试纸伸入纯净Cl2中 | 试纸先变蓝,后褪色 |
| III | … | … |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+ | B. | CH3COO- | C. | HCO3- | D. | NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定序号 | 待测液体积(ml) | 所消耗盐酸标准液的体积(ml) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.70 |
| 2 | 20.00 | 6.00 | 26.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | M点溶液中水的电离程度比原溶液大 | |
| B. | a=0.05 | |
| C. | 当n(NaOH)=0.05mol时溶液中有:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) | |
| D. | 在M点时,n(OH-)-n(H+)=(a-0.05)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  | 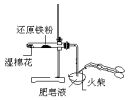 | 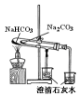 |
| 验证:溶解性AgCl>AgBr>Ag2S | 验证:非金属性Cl>C>Si | 验证:铁粉与水蒸气反应产生的氢气 | 验证:热稳定性 Na2CO3>NaHCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ①常温下,配制0.10moI/L NaHCO3溶液,测其pH为8.4; ②取少量该溶液于试管中,向其中滴加CaCl2溶液至中性,滴加过程中只产生一种白色沉淀(能与盐酸作用产生气体),但无气体放出. |
| A. | NaHCO3溶液呈碱性的原因是HCO3-的水解程度大于电离程度 | |
| B. | 加入CaCl2促进了HCO3-的水解 | |
| C. | 反应的离子方程式是2HCO3-+Ca2+═CaCO3↓+H2CO3 | |
| D. | 反应后的溶液中存在:c(Na+)+2c(Ca2+)═c(HCO3-)+2c(CO32-)+c(Cl-)、 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com