

·ÖĪö £Ø1£©ŗĻ³É°±ŹĒæÉÄę·“Ó¦£¬·“Ó¦Īļ²»ÄÜĶźČ«×Ŗ»Æ£»
£Ø2£©øł¾Żv£ØNH3£©=$\frac{\frac{”÷n}{V}}{”÷t}$½įŗĻ·“Ó¦ĖŁĀŹÖ®±ČµČÓŚĻµŹżÖ®±ČĒóĖć£»
£Ø3£©»ÆŃ§Ę½ŗāדĢ¬ŹĒÕżÄę·“Ó¦ĖŁĀŹĻąµČ£¬ø÷×é·ÖÅØ¶Č±£³Ö²»±äµÄדĢ¬£¬·“Ó¦“ļµ½×ī“óĻŽ¶Č£¬¾Ż“Ė·ÖĪö£»
£Ø4£©Ķ¬Ņ»»Æѧ·“Ó¦ÖŠ£¬Ķ¬Ņ»Ź±¼ä¶ĪÄŚ£¬ø÷ĪļÖŹµÄ·“Ó¦ĖŁĀŹÖ®±ČµČÓŚĘä¼ĘĮæŹżÖ®±Č£»ĻČ°Ń²»Ķ¬ĪļÖŹµÄ·“Ó¦ĖŁĀŹ»»Ėć³ÉĶ¬Ņ»ĪļÖŹµÄ·“Ó¦ĖŁĀŹ½ųŠŠ±Č½Ļ£¬“Ó¶ųČ·¶ØŃ”Ļī£¬×¢Ņāµ„Ī»ŹĒ·ńĻąĶ¬£»
£Ø5£©£Ø1£©ĀČ»Æļ§²»ĪČ¶ØŹÜČČŅ×·Ö½ā£¬µ«ŹĒ°±ĘųÓėĀČ»ÆĒāÓöĄäÓÖ¼«Ņ×·“Ӧɜ³ÉĀČ»Æļ§¹ĢĢ壻
£Ø2£©CaOÓöĖ®Éś³ÉCa£ØOH£©2£¬Ķ¬Ź±·Å³ö“óĮæČČĮ棬ӊĄūÓŚ°±ĘųµÄÉś³É£»
£Ø3£©¹ĢĢå¼ÓČČÖĘĘųĢåŹ±£¬ŹŌ¹ÜæŚÓ¦ĀŌĻņĻĀĒ抱£»
£Ø4£©ÅØ°±Ė®Ņ×»Ó·¢£¬¼ÓČČÄܹ»“Ł½ų°±ĘųµÄŅŻ³ö£®
½ā“š ½ā£ŗ£Ø1£©ŗĻ³É°±ŹĒæÉÄę·“Ó¦£¬·“Ó¦Īļ²»ÄÜĶźČ«×Ŗ»Æ£¬ĖłŅŌ½«1mol N2ŗĶ3mol H2»ģŗĻ£¬Ź¹Ęä³ä·Ö·“Ó¦£¬·Å³öµÄČČĮæ×ÜŠ”ÓŚÉĻŹöŹżÖµ
¹Ź“š°øĪŖ£ŗŗĻ³É°±ŹĒæÉÄę·“Ó¦£¬·“Ó¦Īļ²»ÄÜĶźČ«×Ŗ»Æ£»
£Ø2£©v£ØNH3£©=$\frac{\frac{”÷n}{V}}{”÷t}$=$\frac{\frac{10mol}{2L}}{10min}$=0.5mol/£ØL•min£©£¬ÓÖ·“Ó¦ĖŁĀŹÖ®±ČµČÓŚĻµŹżÖ®±Č£¬ĖłŅŌv£ØN2£©=$\frac{1}{2}$v£ØNH3£©=$\frac{1}{2}$”Į0.5mol/£ØL•min£©=0.25mol/£ØL•min£©£¬
¹Ź“š°øĪŖ£ŗ0.25mol/£ØL•min£©£»
£Ø3£©a£®Õż·“Ó¦ĖŁĀŹŗĶÄę·“Ó¦ĖŁĀŹĻąµČ£¬ĖµĆ÷·“Ó¦“ļµ½Ę½ŗāדĢ¬£¬¹ŹÕżČ·£»
b£®Õż·“Ó¦ĖŁĀŹ×ī“ó£¬Äę·“Ó¦ĖŁĀŹĪŖ0£¬ŹĒÖø·“Ó¦æŖŹ¼Ź±µÄדĢ¬£¬·“Ӧƻӊ“ļµ½Ę½ŗāדĢ¬£¬¹Ź“ķĪó£»
c£®N2µÄ×Ŗ»ÆĀŹ“ļµ½×ī“óÖµ£¬ĖµĆ÷·“Ó¦“ļµ½Ę½ŗāדĢ¬£¬¹ŹÕżČ·£»
d£®N2ŗĶH2µÄÅضČĻąµČ£¬·“Ó¦²»Ņ»¶Ø“ļµ½Ę½ŗāדĢ¬£¬¹Ź“ķĪó£»
e£®N2”¢H2ŗĶNH3µÄĢå»ż·ÖŹżĻąµČ£¬ÓėĘ½ŗāדĢ¬ĪŽ¹Ų£¬¹Ź“ķĪó£»
f£®ŅņĪŖ·“Ó¦Ē°ŗóÖŹĮæ²»±ä£¬ŌņŗćČŻŹ±ĢåĻµĆܶČŅ»Ö±±£³Ö²»±ä£¬ÓėĘ½ŗāדĢ¬ĪŽ¹Ų£¬¹Ź“ķĪó£»
¹Ź“š°øĪŖ£ŗac£»
£Ø4£©·“Ó¦ĪŖN2£Øg£©+3H2£Øg£©?2NH3£Øg£©£¬ŅŌĒāĘųµÄ·“Ó¦ĖŁĀŹĪŖ±ź×¼½ųŠŠÅŠ¶Ļ£»
A”¢V£ØNH3£©=0.5mol/£ØL•min£©£¬·“Ó¦ĖŁĀŹÖ®±ČµČÓŚĘä¼ĘĮæŹżÖ®±Č£¬ĖłŅŌ¦Ķ£ØH2£©=0.75mol/£ØL•min£©£»
B”¢¦Ķ£ØH2£©=0.3mol/£ØL•min£©£»
C”¢¦Ķ£ØN2£©=0.2mol/£ØL•min£©£¬·“Ó¦ĖŁĀŹÖ®±ČµČÓŚĘä¼ĘĮæŹżÖ®±Č£¬ĖłŅŌ¦Ķ£ØH2£©=0.6mol/£ØL•min£©£»
D”¢¦Ķ£ØH2£©=0.01mol/£ØL•S£©=0.6mol/£ØL•min£©£®
ĖłŅŌøĆ·“Ó¦µÄĖŁĀŹÓɓ󵽊”µÄĖ³ŠņŹĒA£¾C=D£¾B£»
¹Ź“š°øĪŖ£ŗA£¾C=D£¾B£»
£Ø5£©£Ø1£©ĀČ»Æļ§²»ĪČ¶ØŹÜČČŅ×·Ö½ā£¬µ«ŹĒ°±ĘųÓėĀČ»ÆĒāÓöĄäÓÖ¼«Ņ×·“Ӧɜ³ÉĀČ»Æļ§¹ĢĢ壬²»ÄÜÓĆÓŚÖʱø°±Ęų£¬¹Ź“ķĪó£»
£Ø2£©ĻņCaOÖŠµĪ¼ÓÅØ°±Ė®£¬CaOÓöĖ®Éś³ÉCa£ØOH£©2£¬Ķ¬Ź±·Å³ö“óĮæČČĮ棬ӊĄūÓŚÅØ°±Ė®ÖŠµÄ°±ĘųŅŻ³ö£¬¹ŹÕżČ·£»
£Ø3£©¹ĢĢå¼ÓČČÖĘĘųĢåŹ±£¬ŹŌ¹ÜæŚÓ¦ĀŌĻņĻĀĒ抱£¬Ź¹²śÉśµÄĖ®Äܹ»Į÷³ö£¬ŅŌĆāĖš»µŹŌ¹Ü£¬ĖłŅŌĄūÓĆĀČ»Æļ§ŗĶĒāŃõ»ÆøĘ¹ĢĢå¼ÓČČÖĘČ”°±ĘųŠčŹŌ¹ÜæŚÓ¦ĀŌĻņĻĀĒ抱£¬¹Ź“ķĪó£»
£Ø4£©ÅØ°±Ė®Ņ×»Ó·¢£¬¼ÓČČÄܹ»“Ł½ų°±ĘųµÄŅŻ³ö£¬æÉŅŌÓĆĄ“Öʱø°±Ęų£¬¹ŹÕżČ·£»
¹ŹŃ”£ŗ£Ø2£©£Ø4£©£®
µćĘĄ ±¾Ģāæ¼²éĮĖæÉÄę·“Ó¦µÄģŹ±ä”¢»Æѧ·“Ó¦ĖŁĀŹµÄ¼ĘĖć¼°“óŠ”±Č½Ļ”¢»ÆŃ§Ę½ŗāדĢ¬µÄÅŠ¶ĻŅŌ¼°°±ĘųµÄŹµŃéŹŅÖʱø·½·Ø£¬ÕĘĪÕ°±ĘųµÄÖʱøŌĄķŗĶ»ÆѧŠŌÖŹŹĒ½ā“šµÄ¹Ų¼ü£¬ĢāÄæÄŃ¶Č²»“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
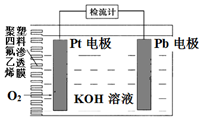 µē³ŲŹ½Ńõ“«øŠĘ÷ŌĄķ¹¹ŌģČēĶ¼£¬æɲā¶ØO2µÄŗ¬Į森¹¤×÷Ź±Ē¦¼«±ķĆę»įÖš½„ø½×ÅPb£ØOH£©2£®ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©
µē³ŲŹ½Ńõ“«øŠĘ÷ŌĄķ¹¹ŌģČēĶ¼£¬æɲā¶ØO2µÄŗ¬Į森¹¤×÷Ź±Ē¦¼«±ķĆę»įÖš½„ø½×ÅPb£ØOH£©2£®ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©| A£® | Ptµē¼«ÉĻ·¢Éś»¹Ō·“Ó¦ | |
| B£® | Ėę×ÅŹ¹ÓĆ£¬µē½āŅŗµÄpHÖš½„¼õŠ” | |
| C£® | a mmolO2·“Ó¦£¬ĄķĀŪÉĻæÉŹ¹Pbµē¼«ŌöÖŲ68a mg | |
| D£® | Pbµē¼«ÉĻµÄ·“Ó¦Ź½ĪŖPb+2OH--2e-=Pb£ØOH£©2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | µē½āÖŹĪŖNaClČÜŅŗ£¬Õż¼«·“Ó¦ĪŖH2+2e-=2H+ | |
| B£® | µē½āÖŹĪŖNaOHČÜŅŗ£¬Õż¼«·“Ó¦ĪŖO2+2e-=2OH- | |
| C£® | µē½āÖŹĪŖHClČÜŅŗ£¬Õż¼«·“Ó¦ĪŖO2+4e-+4H+=2H2O | |
| D£® | µē½āÖŹĪŖNa2CO3ČÜŅŗ£¬Õż¼«·“Ó¦ĪŖH2+2e-+CO32-=H2O+CO2”ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | pH=9.25”¢ÅØ¶Č¾łĪŖ0.1 mol•L-1µÄNH4C1”¢NH3•H2O»ģŗĻČÜŅŗ£ŗc£ØNH4+£©+c£ØH+£©£¾c£ØNH3•H2O£©+c£ØOH-£© | |
| B£® | 0.1mol/LH2SO4ČÜŅŗÓė0.1mol/LNaOHČÜŅŗµČĢå»ż»ģŗĻ£ŗc£ØH+£©ØTc£ØSO42-£©+c£ØOH-£© | |
| C£® | Ļņ0.10mol•L-1NaHSO3ČÜŅŗÖŠĶØNH3ÖĮpH=7£ŗc£ØNa+£©£¾c£ØSO32-£©£¾c£ØNH4+£© | |
| D£® | CO2ĶØČėKOHČÜŅŗ£¬µ±ÓÉĖ®µēĄėµÄH+ÅضČĪŖ10-7mol/L£¬Ņ»¶Ø“ęŌŚ£ŗc£ØK+£©=2c£ØCO32-£©+c£ØHCO3-£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ±½ÖŠ¼ÓČėäåĖ®ŗóäåĖ®²ćŃÕÉ«±äĒ³£¬ÕāŹĒÓÉÓŚ·¢ÉśĮĖČ”“ś·“Ó¦ | |
| B£® | ŅŅĻ©ŗĶ±½·Ö×ÓÖŠĖłÓŠŌ×ÓŌŚĶ¬Ņ»Ę½ĆęÉĻ | |
| C£® | Ņ»ĀȱūĶé£ØC3H7Cl£©µÄĶ¬·ÖŅģ¹¹Ģå¹²ÓŠ3ÖÖ | |
| D£® | ±ź×¼×“æöĻĀ£¬2.24LCHCl3ŗ¬ÓŠµÄ·Ö×ÓŹżĪŖ0.1NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | A Ō×Ó×īĶā²ćµē×ÓŹż±Č B Ō×ÓµÄ×īĶā²ćµē×ÓŹżÉŁ | |
| B£® | A Ō×Óµē×Ó²ćŹż±Č B Ō×ӵĵē×Ó²ćŹż¶ą | |
| C£® | ³£ĪĀŹ±£¬AÄÜ“ÓĖįÖŠÖĆ»»³öĒā£¬¶ųB²»ÄÜ | |
| D£® | 1molA“ÓĖįÖŠÖĆ»»Éś³ÉµÄ H2±Č 1mol B“ÓĖįÖŠÖĆ»»Éś³ÉµÄ H2¶ą |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ė«ŃõĖ® | B£® | äåĖ® | C£® | ĒāŃõ»ÆÄĘČÜŅŗ | D£® | ĻõĖįŅųČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ±ź×¼×“æöĻĀ£¬22.4 LµÄCH3ClÖŠ¹²ÓƵē×Ó¶ŌŹżĪŖ3NA | |
| B£® | ³£ĪĀĻĀ£¬1 L 0.1mol•L-1µÄNH4NO3ČÜŅŗÖŠµŖŌ×ÓŹżĪŖ0.2 NA | |
| C£® | ŌŚ·“Ó¦KIO3+6HIØTKI+3I2+3H2OÖŠ£¬ĆæÉś³É3molI2×ŖŅʵĵē×ÓŹżĪŖ6 NA | |
| D£® | 0.1molŅŅĖįÓė0.1molŅŅ“¼·“Ӧɜ³ÉŅŅĖįŅŅõ„µÄ·Ö×ÓŹżĪŖ0.1NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| Ń”Ļī | A | B | C | D |
| ŹµŃé ÄæµÄ | ¼ģŃéÕįĢĒÓėÅØĮņĖį·“Ó¦²śĪļÖŠÓŠCO2 | Ö¤Ć÷Fe£ØNO3£©2ČÜŅŗÖŠ“ęŌŚFe2+µÄĖ®½āĘ½ŗā | ¼ģŃéijČÜŅŗÖŠŗ¬ÓŠAg+ | ±Č½Ļ·Ē½šŹōŠŌ£ŗS£¾C£¾Si |
| ŹµŃé ²Ł×÷ | ½«ÅØĮņĖįµĪČėŌ²µ×ÉÕĘæÖŠ£¬ŌŁ½«Éś³ÉµÄĘųĢåĶØČė³ĪĒåŹÆ»ŅĖ® | ½«Ļ”ĻõĖįµĪČėFe£ØNO3£©2ČÜŅŗÖŠ | Ļņ“ż¼ģŅŗÖŠµĪ¼Ó×ćĮæµÄĻ”ŃĪĖį | ½«Ļ”ĮņĖįµĪČė׶ŠĪĘæÖŠ£¬ŌŁ½«Éś³ÉµÄĘųĢåĶØČėNa2SiO3ČÜŅŗÖŠ |
| ĖłÓĆ ×°ÖĆ | 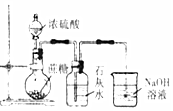 | 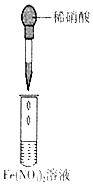 | 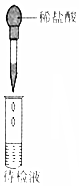 | 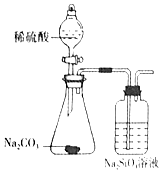 |
| A£® | A | B£® | B | C£® | C | D£® | D |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com