解:(1)由工艺流程及③可知,利用Fe(NO
3)
3与KClO制备K
2FeO
4,由信息②可知温度较高KOH与Cl
2 反应生成的是KClO
3.由信息①可知,在低温下KOH与Cl
2 反应生成的是KClO.故选择低温较低,故答案为:温度较低;
(2)工业是利用电解饱和食盐水制取氯气.反应方程式为:2NaCl+2H
2O

2NaOH+H
2↑+Cl
2↑,
故答案为:2NaCl+2H
2O

2NaOH+H
2↑+Cl
2↑;
(3)K
2FeO
4中铁元素化合价为+6价,价态高,易得电子,表现强氧化性,+6价的Fe元素易得电子表现出强氧化性,可杀菌消毒;还原产物Fe元素为+3价,在水中形成Fe(OH)
3胶体,可吸附水中悬浮物并可使泥沙聚沉,
故答案为:+6价的Fe元素易得电子表现出强氧化性,可杀菌消毒;还原产物Fe元素为+3价,在水中形成Fe(OH)
3胶体,可吸附水中悬浮物并可使泥沙聚沉;
(4)61.6g KOH固体的物质的量为

=1.1mol,溶液的质量为100mL×1g/mL+61.6g=161.6g,所以溶液的体积为

=

L,所以氢氧化钾溶液的物质的量浓度为

=10mol/L,故答案为:10mol/L;
(5)由工艺流程可知,反应液I中有过量的Cl
2反应,加KOH固体的目的是与过量的Cl
2继续反应,生成更多的KClO.为下一步反应提供反应物,
故答案为:与“反应液I”中过量的Cl
2继续反应,生成更多的KClO;为下一步反应提供反应物;
(6)由工艺流程及③可知,从“反应液II”中分离出K
2FeO
4后,会有副产品KNO
3、KCl,故答案为:KNO
3、KCl.
分析:(1)由工艺流程及③可知,利用Fe(NO
3)
3与KClO制备K
2FeO
4,由信息②可知温度较高KOH与Cl
2 反应生成的是KClO
3;
(2)工业是利用电解饱和食盐水制取氯气;
(3)K
2FeO
4中铁元素化合价为+6价,价态高,+6价的Fe元素易得电子表现出强氧化性,可杀菌消毒;还原产物Fe元素为+3价,在水中形成Fe(OH)
3胶体,可吸附水中悬浮物并可使泥沙聚沉;
(4)根据n=

计算出氢氧化钾的物质的量,溶液质量等于溶质质量与溶剂质量之和,利用V=
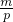
计算溶液体积,再根据c=

计算氢氧化钾溶液的物质的量浓度;
(5)由工艺流程可知,反应液I中有过量的Cl
2反应,生成更多的KClO;
(6)由工艺流程及③可知,从“反应液II”中分离出K
2FeO
4后,会有副产品KNO
3、KCl.
点评:本题考查学生阅读题目获取信息的能力、对工艺流程的理解与条件的控制、对物质的量浓度理解等,难度中等,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力,注意基础知识的掌握.


 2NaOH+H2↑+Cl2↑,
2NaOH+H2↑+Cl2↑, 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑; =1.1mol,溶液的质量为100mL×1g/mL+61.6g=161.6g,所以溶液的体积为
=1.1mol,溶液的质量为100mL×1g/mL+61.6g=161.6g,所以溶液的体积为 =
= L,所以氢氧化钾溶液的物质的量浓度为
L,所以氢氧化钾溶液的物质的量浓度为 =10mol/L,故答案为:10mol/L;
=10mol/L,故答案为:10mol/L; 计算出氢氧化钾的物质的量,溶液质量等于溶质质量与溶剂质量之和,利用V=
计算出氢氧化钾的物质的量,溶液质量等于溶质质量与溶剂质量之和,利用V=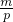 计算溶液体积,再根据c=
计算溶液体积,再根据c= 计算氢氧化钾溶液的物质的量浓度;
计算氢氧化钾溶液的物质的量浓度;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 (FeSO4?7H2O)一起净水,其原理为
(FeSO4?7H2O)一起净水,其原理为 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH 溶液的pH为
溶液的pH为