
【题目】溴酸银(AgBrO3)溶解度随温度变化曲线如图所示。下列说法正确的是
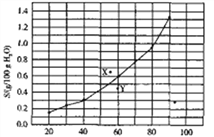
A. 溴酸银的溶解是一个熵增、焓减过程
B. 对应温度下,X点的分散系中,V(溶解)>v(沉淀)
C. Y点的分散系中,c(Ag+)·c(BrO3-)>6.25×10-4
D. 60 ℃时溴酸银饱和溶液中c(BrO3-)=0.025mol·L-1
【答案】D
【解析】A项,由溶解度随温度的变化曲线可知:温度升高,该物质的溶解度增大,所以溴酸银(AgBrO3)溶解是吸热过程(焓增过程),故A项错误;B项,由图像可知:X点的溶液中溶质处于过饱和状态,所以V(溶解)<v(沉淀),故B项错误; 60℃溴酸银的溶解度大约是0.6g,则c(AgBrO3)= (0.6g÷236g/mol)÷0.1L=0.025mol/L,所以60 ℃时溴酸银饱和溶液中c(BrO3-)=c(Ag+)=0.025mol·L-1,Ksp(AgBrO3)= c(Ag+)·c(BrO3-)=6.25×10-4,图中Y点的溶液未达饱和,此时c(Ag+)·c(BrO3-)<6.25×10-4,故C项错误、D项正确。 综上所述,符合题意的选项为D。


科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)上述十种元素中,最高价氧化物水化物酸性最强的化合物的化学式是___________,(填化学符号,下同),最高价氧化物水化物碱性最强的化合物的化学式是_____________,最高价氧化物水化物显两性的氢氧化物的化学式是_____________。
(2)③与④的气态氢化物的稳定性由大到小的顺序是_____________。
(3)④、⑤、⑥的离子半径由大到小的顺序是__________________。
(4)①、③形成的阳离子的电子式是______________。
(5)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8kJ·mol-1
Fe2O3(s)+![]() CO(g)=
CO(g)=![]() Fe3O4(s)+CO2(g) △H=-15.73 kJ·mol-1
Fe3O4(s)+CO2(g) △H=-15.73 kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640.4 kJ·mol-1
则14g CO气体还原足量FeO固体得到固体Fe和CO2气体时,对应的△H为
A.-218 kJ·mol-1 B.-109 kJ·mol-1
C.+218 kJ·mol-1 D.+109 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若一个原子在第三电子层上有10个电子,则该层的电子排布式可以写成
A. 3s10 B. 3d10 C. 3s23p63d2 D. 3s23p64s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取四个干燥的烧瓶,分别装入标准状况下的干燥氨气、含有二分之一体积空气的氯化氢、二氧化氮和氧气(体积比为4∶1)的混合气体、二氧化氮和氧气(体积比为4∶3)的混合气体;然后分别做溶解于水的喷泉实验。实验结束后四个烧瓶中所得溶液的物质的量浓度之比为 ( )
A. 2∶1∶2∶2 B. 5∶5∶5∶4
C. 5∶5∶4∶4 D. 7∶7∶4∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素原子半径与原子序数的关系如图,则下列说法正确的是( )

A . Z、N两种元素形成的化合物熔融状态下可以导电
B.X、N两种元素的气态氢化物的沸点相比,前者较低
C.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液中
D.由X与M两种元素组成的化合物能与水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是由法国化学家沃克兰于1798年在巴黎发现的。目前铬被广泛应用于冶金、化工、铸铁、耐火及高精端科技等领域。
(1)铬元素基态原子的电子排布式为____________,其核外未成对电子数为__________。
(2)金属铬的第二电离能(ICr)和锰的第二电离能(IMn)分别为1590.6kJ·mol-1、1509.0 kJ·mol-1,ICr>IMn的原因是__________。
(3)雷氏盐(Reinecke salt)的化学式为NH4[Cr(NCS)4(NH3)2].H2O是一种易溶于水和乙醇的暗红色固体。
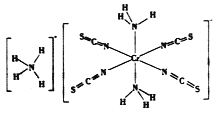
①雷氏盐中铬元素的化合价为_______,NH3与铬离子形成的化学键为__________。
②NCS-的立体构型是________,其中碳原子的杂化轨道类型为_______。SO2、CO2、BaCl2、SCl2四种分子中,与NCS-互为等电子体的是_____________。
③乙醇的沸点比溴乙烷高,其原因是__________。
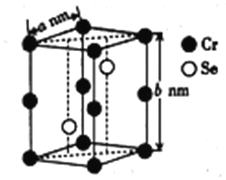
(4)硒化铬的晶胞结构如图所示,晶胞参数为anm和bnm,则硒化铬的密度为____________g·cm-3(列出表达式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com