
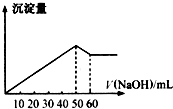
 (1)在某Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为
(1)在某Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为| 1.12L |
| 22.4L/moL |
| 11.2L |
| 22.4L/mol |
| 1 |
| 2 |
| 1 |
| 3 |
| 1 |
| 2 |
| 1.12L |
| 22.4L/moL |
| 0.45mol |
| 1mol/L |
| 11.2L |
| 22.4L/mol |
| 16g |
| 0.5mol |
 ;
; ;
;

 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
| A、Cl2 |
| B、盐酸 |
| C、KMnO4 |
| D、FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡常数随温度的改变而改变 | ||||||
| B、对于密闭容器中反应2SO2+O2?2SO3,2体积SO2与足量O2反应,能生成2体积SO3 | ||||||
| C、合成氨反应中使用催化剂,降低了反应所需要的活化能 | ||||||
D、反应H2(g)+I2(g)?2HI(g) 在450℃时,其平衡常数为49;则反应HI(g)?
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 用如图装置进行实验,将A逐滴加入B中:
用如图装置进行实验,将A逐滴加入B中:查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ③ | ④ | ⑤ |
| 0.001mol?L-1 CH3COOH溶液 | pH=10 NaOH溶液 | 0.001mol?L-1 NaOH溶液 | pH=4 CH3COOH溶液 | pH=4 NH4Cl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO4是酸,因为H2SO4中含有氢元素 |
| B、氯化钠晶体不能导电,所以氯化钠不是电解质、 |
| C、2Na+2H2O═2NaOH+H2↑不是离子反应,因为反应中没有离子参加 |
| D、8NH3+3Cl2═N2+6NH4Cl是氧化还原反应,因为反应中存在电子的转移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com