
【题目】20 mL浓度为0.05 mol/L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol/L的NaXO4溶液完全反应。溶液中XO4-被还原为较低价态,则X元素的化合价变为
A. +1 B. +2 C. +3 D. +4
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是中学常见的四种短周期元素,其原子序数依次增大,且原子核外最外层电子数都不少于2 ,X族序数与最外层电子数相等。四种元素的单质均能在氧气中燃烧,生成四种相对分子质量都大于26的氧化物,其中有两种氧化物能溶于稀硫酸,三种能溶于烧碱溶液。四种元素单质的混合物有如下性质:

下列说法正确的是
A. 原子半径:X>Y>Z>W
B. 简单气态氢化物的热稳定性:W>X
C. 最高价氧化物对应的水化物的碱性:Z>Y
D. X和W组成的化合物常作砂纸、砂轮的磨料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】防治雾雾霾天气的主要措施有机动车临时交通管制、工矿企业停业限产、扬尘污染控制等。
(l) PM2.5是环保部门监测空气质量的重要指标。将某PM2.5样本用蒸馏水处理制成待测试样,测得试样中无机离子的种类和平均浓度如下表:
离子种类 | Na+ | NH4+ | SO42- | NO3- |
浓度/(mol/L) | 2.0×l0-6 | 2.8×10-5 | 3.5×10-5 | 6.0×l0-5 |
则试样的pH为____________。
(2)雾霾的主要成分之一是来自汽车尾气的氮氧化物,研究表明CH4可以消除汽车尾气中氮氧化物的污染。
① CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-889.6KJ/mol
② N2(g)+2O2(g)=2NO2(g)ΔH=+67.2KJ/mol
③ 2NO2(g) ![]() N2O4(g) ΔH=-56.9KJ/mol
N2O4(g) ΔH=-56.9KJ/mol
写出甲烷气体催化还原N2O4气体生成稳定的单质气体、二氧化碳气体和液态水的热化学方程式:_____。
(3)一定条件下,以CO 和H2合成清洁能源CH3OH,其热化学方程式为CO(g) + 2H2(g) ![]() CH3OH (g) ΔH,CO的平衡转化率与温度、压强的关系如图所示:
CH3OH (g) ΔH,CO的平衡转化率与温度、压强的关系如图所示:
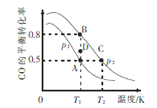
①该可逆反应的ΔH_____0(填“>”“<”“=”)。A,B, C三点对应的平衡常数KA、KB、KC的大小关系是_________。压强:p1_______p2(填“>”“<”“=”)。在T1条件下,由D点到B点过程中,正、逆反应速率之间的关系:v正________v逆(填“>”“<”“=”)。
②若在恒温恒容条件下进行上述反应,能表示该可逆反应达到平衡状态的是__________(填字母)
A. CO的体积分数保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内消耗CO的浓度等于生成CH3OH的浓度
③向恒压密闭容器中充入2mol CO和4mol H2,在p2、T2条件下达到平衡状态C点,此时容器容积为2L,则在该条件下反应的平街常数K为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表短周期的一部分
① | ||||||||
② | ③ | ④ | ||||||
⑤ | ⑥ | ⑦ | ⑧ | |||||
(1)①~⑦元素中金属性最强的元素是___________(用元素符号表示)。
(2)④与⑤形成的化合物的电子式为____________。
(3)表中元素②、③、⑦最高价含氧酸的酸性由强到弱的顺序是______(填化学式)。
(4)第116号元素(元素符号Lv)被中国科学技术名词审定委员会命名为“![]() ”,该元素在元素周期表中的位置是_____________,属于______元素(填“金属”或“非金属”),若该元素存在最高价氧化物对应的水化物,则其化学式为_______。
”,该元素在元素周期表中的位置是_____________,属于______元素(填“金属”或“非金属”),若该元素存在最高价氧化物对应的水化物,则其化学式为_______。
(5)核内中子数为N的R2+,质量数为A,则ng它的相同价态氧化物中所含的电子的物质的量约为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制备气体和验证气体性质的装置图,若利用该装置实现碳和浓硫酸的反应,并进行如下验证:

(1)实验步骤: 连接仪器、_________________、加药品后,然后滴入浓硫酸,加热。
(2)C与浓硫酸反应的化学方程式是___________________________。
(3)若要证明产物中的两种气体,装置B、C、D、E中分别装有品红溶液、酸性KMnO4溶液、品红溶液、澄清石灰水,则B、D装置中品红溶液的作用分别是________________,_________________。证明气体中有CO2的现象是____________________________。
(4)将A产生的气体通入下图装置(忽略氧气对反应的影响)进行如下探究实验。
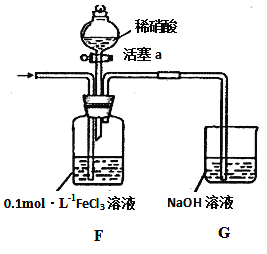
实验记录如下:
实验序号 | 实验操作 | 实验现象 |
I | 向F装置中通入一段时间的气体. | F中溶液色溶液最终变为浅绿色 |
II | 取出少量F装置中的溶液,先加入 KSCN溶液,再加入BaCl2溶液 | 加入KSCN溶液后溶液不变色;再加入BaCl2溶液产生白色沉淀. |
III | 打开活塞a,将过量稀HNO3加入装置F中,关闭活塞a | F中浅绿色溶液最终变为黄色. |
IV | 取出少量A装置中的溶液,加入KSCN溶液 | 溶液变为红色. |
实验II中发生反应的离子方程式是_____________________;实验III中,浅绿色溶液变为黄色的原因是___________________________________________ (用语言叙述);综合上述实验得岀的结论是:在酸性条件下,NO3﹣、Fe3+氧化性强弱顺序为_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 二氧化硅用于制备太阳能
B. 二氧化硅是生产光导纤维的主要材料
C. 从海水中提取物质不一定必须通过化学反应才能实现
D. 氢氟酸不能保存在玻璃瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磺化钠在医药中用作甲状腺肿瘤防治剂、袪痰剂和利尿剂,也用作食品添加剂、感光剂等。工业上用水合肼(N2H4·H2O)还原法制取碘化钠固体,其制备流程如图所示:
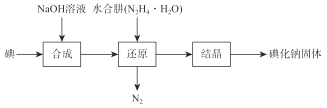
己知:N2H4·H2O在100℃以上分解。
(1)在合成NaI的过程中,可能混有的物质是_______,生产过程中要适当补充NaOH,目的是________。
(2)在还原过程中,为了防止水合肼(N2H4·H2O)高温分解,反应温度控制在60~70℃,温度也不能过低,其原因是___________。工业上也可以用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因是_____________________。
(3)请设计一个简单的实验来检验还原液中是否含有IO3-:__________________。(可供选择的试剂:稀硫酸、淀粉溶液、FeCl3溶液)
(4)测定产品中NaI含量的实验步骤如下:
a.称取4.000 g样品并溶解,在250 mL容量瓶中定容;
b.量取25.00 mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入A溶液作指示剂;
c.用0.1000mol·L-1的Na2S2O3溶液滴定至终点(发生反应方程式为:2Na2S2O3+I2=Na2S4O6+2NaI),重复测定3次,所得的相关数据如表所示:
测定序号 | 待测体积/ml | 盛装标准滴定管的起点读数/ml | 盛装标准滴定管的终点读数/ml |
1 | 25.00 | 0.06 | 24.04 |
2 | 25.00 | 0.02 | 24.02 |
3 | 25.00 | 0.12 | 24.14 |
①在滴定过程中,Na2S2O3溶液应放___________(填仪器)中;加入的A物质为____________(填名称)。
②滴定终点观察到的现象为_______________________。
③该样品中NaI的含量为_______________________。
④若用上述方法测得NaI的含量偏低(忽略测定过程中的误差),则可能的原因是_________________。
(5)碘化钠固体的保存方法是_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com