
下列叙述正确的是( )
|
| A. | ⅠA族元素单质的熔点从上往下逐渐降低 |
|
| B. | 分子晶体中一定存在共价键 |
|
| C. | ⅥA族元素的氢化物中,稳定性最好的其沸点也最高 |
|
| D. | 同周期非金属氧化物对应的水化物的酸性从左往右依次增强 |
考点:
元素周期表的结构及其应用;元素周期律的作用;共价键的形成及共价键的主要类型.
专题:
元素周期律与元素周期表专题.
分析:
A.碱金属单质的电荷相同,半径越大,单质的熔点越低;
B.稀有气体形成的晶体中不存在化学键;
C.ⅥA族元素的氢化物中,稳定性最好为水,含氢键;
D.同周期从左向右非金属性增强.
解答:
解:A.碱金属元素的原子的半径随原子序数的增大而增大,则单质的熔点随原子序数的增大而降低,但H元素的单质最低,故A错误;
B.稀有气体形成的晶体中不存在化学键,则分子晶体中不一定存在共价键,故B错误;
C.ⅥA族元素的氢化物中,因O的非金属性最强,则稳定性最好为水,含氢键,则沸点最大,故C正确;
D.同周期从左向右非金属性增强,则非金属氧化物对应的水化物的酸性从左往右依次增强,但第二周期除外(O、F没有正价),故D错误;
故选C.
点评:
本题考查元素周期表的结构及应用,为高频考点,把握元素的位置、性质及元素周期律为解答的关键,注意元素的性质特例,题目难度不大.


科目:高中化学 来源: 题型:
A、B、C都是有机化合物,且有如下转化关系:A B
B C,A的相对分子质量比B大2,C的相对分子量比B大16,C能与过量的NaOH反应生成一种常见的气体,以下说法正确的是( )
C,A的相对分子质量比B大2,C的相对分子量比B大16,C能与过量的NaOH反应生成一种常见的气体,以下说法正确的是( )
|
| A. | A是乙炔,B是乙烯 | B. | A是乙烯,B是乙烷 |
|
| C. | A是乙醇,B是乙醛 | D. | A是环己烷,B是苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在2 L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图。反应在t时刻达到平衡,依图所示:
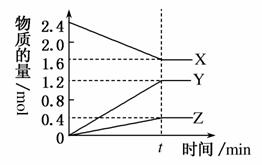
(1)该反应的化学方程式是___________________________。
(2)反应起始至t,Y的平均反应速率是_________________。
(3)X的转化率是_____________________________________。
(4)关于该反应的说法正确的是________。
A.到达t时刻反应已停止
B.在t时刻之前X的消耗速率大于它的生成速率
C.在t时刻正反应速率等于逆反应速率
D.在t时刻达到平衡是因为此时反应物总物质的量与生成物总物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
在某温度时,水的离子积为1.0×10-12 mol2·L-2,若该温度下某溶液中[H+]为1.0×10-7 mol·L-1,则该溶液( )
A.呈碱性 B.呈酸性 C.呈中性 D.[OH-]=1 000[H+]
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
|
| A. | 常温常压下,1mol C2H4所含的电子数为12NA |
|
| B. | 标准状况下,16g甲烷中共价键数目为4NA |
|
| C. | 常温常压,4 g氦气所含的核外电子数为4NA |
|
| D. | 16g氧气和臭氧的混合物中含有1.5NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的锌粉和6mol•L﹣1的过量盐酸反应,当向其中加入少量的下物质:①石墨 ②CuO ③铜粉 ④锌粒 ⑤浓盐酸 ⑥无水乙酸 ⑦KNO3溶液 ⑧CuCl2时,能够加快反应速率,又不响产生H2总量的是( )
|
| A. | ①③④ | B. | ①③⑤ | C. | ②④⑧ | D. | ①⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
在1LK2SO4和CuSO4的混合溶液中,c(SO42﹣)=2.0mol•L﹣1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L(标况)气体,则原溶液中K+的物质的量浓度为( )
|
| A. | 2.0mol•L﹣1 | B. | 1.5mol•L﹣1 | C. | 1.0mol•L﹣1 | D. | 0.5mol•L﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
关于次氯酸性质的描述,错误的是( )
|
| A. | 不稳定,易分解放出氧气 | B. | 能使潮湿的有色布条褪色 |
|
| C. | 具有漂白作用和消毒作用 | D. | 是一种比碳酸酸性强的酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),下列说法错误的是( )
|
| A. | 电池工作时,锌失去电子 |
|
| B. | 电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e﹣═Mn2O3(s)+2OH﹣(aq) |
|
| C. | 电池工作时,电子由正极通过外电路流向负极 |
|
| D. | 外电路中每通过O.2mol电子,锌的质量理论上减小6.5g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com