
 甲、乙、丙、丁、戊五种物质是中学化学常见的物质,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法正确的是( )
甲、乙、丙、丁、戊五种物质是中学化学常见的物质,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法正确的是( )| A. | 若甲可以与NaOH溶液反应放出H2,则丙一定是两性氧化物 | |
| B. | 若甲为短周期中最活泼的金属,且戊为碱,则丙生成戊一定是氧化还原反应 | |
| C. | 若丙、丁混合产生大量白烟,则乙可能具有漂白性 | |
| D. | 若甲、丙、戊都含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为甲<丙<戊 |
分析 A.甲为单质,若甲可以与NaOH溶液反应放出H2,则甲为Al或Si;
B.若甲为短周期中最活泼的金属,且戊为碱,则甲为Na,乙为氧气,所以丙可以为氧化钠或过氧化钠;
C.丙、丁混合产生白烟,则丙、丁可为HCl和NH3或HNO3和NH3等,甲、乙均为单质,则乙可能是氯气或氢气或氮气;
D.若甲、丙、戊含有同一种元素,当甲为S,乙为氧气,丙为二氧化硫,戊为硫酸,则含S元素的化合价由低到高的顺序为甲<丙<戊.
解答 解:A.甲为单质,若甲可以与NaOH溶液反应放出H2,则甲为Al或Si,所以丙可能是氧化铝,也可能是二氧化硅,不一定是两性氧化物,故A错误;
B.若甲为短周期中最活泼的金属,且戊为碱,则甲为Na,乙为氧气,所以丙可以为氧化钠或过氧化钠,当丙为氧化钠时,丙生成戊不是氧化还原反应,故B错误;
C.丙、丁混合产生白烟,则丙、丁可为HCl和NH3或HNO3和NH3等,甲、乙均为单质,则乙可能是氯气或氢气或氮气,都不具有漂白性,故C错误;
D.若甲、丙、戊含有同一种元素,当甲为S,乙为氧气,丙为二氧化硫,丁为HClO等具有强氧化性的物质,戊为硫酸,则含S元素的化合价由低到高的顺序为甲<丙<戊,故D正确;
故选D.
点评 本题考查无机物的推断,熟悉物质的性质及转化关系图中的反应是解答本题的关键,注意选项D为解答的难点,符合甲、丙、戊中同种元素的化合价升高为非金属元素或变价金属元素,题目难度较大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 复合材料由基体和增强体组成,其中基体起骨架作用,增强体起黏结作用 | |
| B. | 玻璃钢是玻璃纤维增强树脂,具有很好的耐腐蚀性,在排水工程中有广泛应用 | |
| C. | 碳纤维增强金属基复合材料具有很高的强度,可用于制作飞机的机翼和机身 | |
| D. | 碳纤维增强陶瓷保持了陶瓷的耐高温的特性,可用于飞机机身的隔热材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
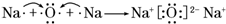 .A、B两种元素还可以形成A2B2型化合物,写出该化合物的电子式
.A、B两种元素还可以形成A2B2型化合物,写出该化合物的电子式 .
.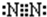 ;
; ;
;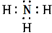 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
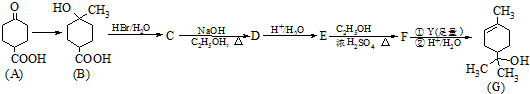
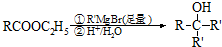
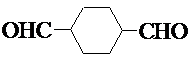 .
.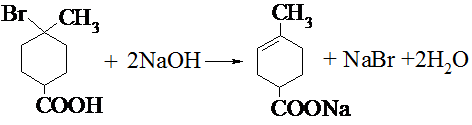 .
.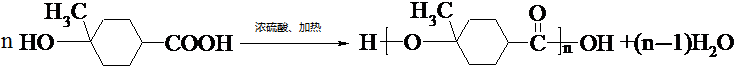 .
.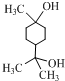 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该绿色晶体配体是氯离子和水,它们物质的量之比为1:5 | |
| B. | 紫色晶体配合物的化学式为[Ti(H2O)6]Cl3 | |
| C. | 上述两种晶体的分子式相同,但结构不同,所以性质不同 | |
| D. | 0.01mol 紫色晶体在水溶液中与过量AgNO3作用最多可得到 2.78 g 沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热 | |
| B. | 热化学方程式各物质前的化学计量数只表示分子个数不代表物质的量 | |
| C. | 燃烧热或中和热是反应热的种类之一 | |
| D. | 对于H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl△H<0,断开1mol H-H键和1mol Cl-Cl键所吸收的总能量大于形成2mol H-Cl键所放出的能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com