
| A.常温下,0.01mol?L-1醋酸溶液pH=2 |
| B.95℃纯水的pH<7,说明加热可导致水呈酸性 |
| C.常温下,将pH=3的醋酸溶液稀释至10倍后溶液pH=4 |
| D.常温下,将0.2mol?L-1的盐酸与等体积水混合后溶液pH=1 |
科目:高中化学 来源:不详 题型:单选题
| KSP |
| A.①④ | B.②③ | C.③④ | D.①② |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
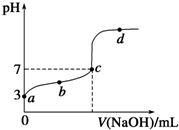
| A.a点表示溶液中c(CH3COO-)约为10-3mol/L | ||
| B.b点表示的溶液中c(Na+)>c(CH3COO-) | ||
| C.c点表示CH3COOH和NaOH恰好反应完全 | ||
D.d点表示的溶液中
|
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.等于0.3mol?L-1氨水溶液的pH |
| B.等于0.2mol?L-1氨水溶液的pH |
| C.大于0.3mol?L-1氨水溶液的pH |
| D.小于0.2mol?L-1氨水溶液的pH |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③ | B.②④ | C.②③④ | D.①②③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.等于10s | B.等于12s | C.大于12s | D.小于12s |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com