
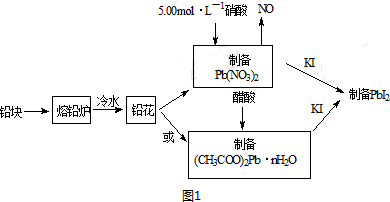
| ʵ������ | ʵ�鷽�� | ʵ������ԭ����� |
| �ٵ�����Ũ�������ƽ���Ӱ�� | ȡPbI2������Һ������һ֧�Թ��У��ٵ��뼸��NaI������Һ | ������Һ��c��I-������ʹQ������PbI2��Ksp |
| ��Ǧ����Ũ�ȼ�С��ƽ���Ӱ�� | ȡPbI2����Һ������һ֧�Թ��У��ټ�������NaCl������Һ | ����ɫ������ʧ ԭ���γ�PbCl42-��������Һ��c��Pb2+����С��ʹQcС��PbI2��Ksp |
| ��Ǧ���Ӻ͵�����Ũ�ȶ���С��ƽ���Ӱ�� | ��PbI2����Һ�е��뼸��FeCl3������Һ | ����ɫ������ʧ д����Ӧ�����ӷ���ʽ��PbI2+2Fe3++4Cl-=PbCl42-+2Fe2++I2 |
���� ��1����Ӧ��Ӵ����Խ���䷴Ӧ����Խ�죻
��2��Ǧ�ܽ���ϡ����ķ�Ӧ����ʽΪ3Pb+8HNO3=3Pb��NO3��2+2NO��+4H2O������Pb������֮��Ĺ�ϵʽ�������ĵ����
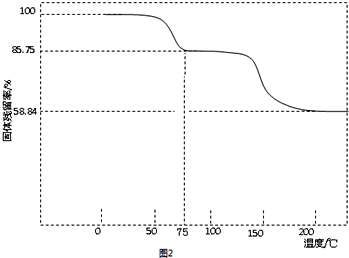
��3���ٿɼ�����ʼ��������Ϊ100g������ȵ�75��ʱ��ȫʧȥ�ᾧˮ���������ǹ������������������ˮ�����ʵ���������Ǧ�����ʵ������������ߵ����ʵ���֮�ȿ�ȷ��n��ֵ��
�ڴ���Ǧ�������ȷֽ�ʣ�����ΪǦ��������ɸ���ʣ�����������Ǧ��̼ԭ���غ���ȷ���л����Ħ���������Ʋ��л���ķ�����ɣ�
��4����������к͵�ԭ���ɼ������Һ�е�c��H+��������Ϲ�ϵʽȷ����Һ��c��Pb2+�����ټ���Ksp��
��5��Ӱ�컯ѧƽ���ƶ�������-Ũ�ȣ�����Ӧ���С�����Ũ�ȣ�����������У������������С��Ӧ�Ũ��ƽ��������У�
��� �⣺��1����Ӧ��Ӵ����Խ���䷴Ӧ����Խ�죬��Ǧ���Ƴ�Ǧ������Ӧ��Ӵ��������Ӧ���ʾ��죬
�ʴ�Ϊ����������ĽӴ�������ӿ��ܽⷴӦ���ʣ�
��2��31.05gǦ�����ʵ���Ϊ$\frac{31.05g}{207g/mol}$=0.15mol�����ݷ�Ӧ����ʽ3Pb+8HNO3=3Pb��NO3��2+2NO��+4H2O��֪���ĵ�n��HNO3��=0.15mol��$\frac{8}{3}$=0.4mol����������Һ�����Ϊ0.4mol��5.00mol•L-1=0.08L=80.0mL���ʴ�Ϊ��80��
��3���ټ�����Ʒ����ʼ����Ϊ100�ˣ����ݹ�������ʵĹ�ʽ��֪��75��ʱʣ�����Ϊ87.75�ˣ����ɵ�ˮ����Ϊ100g-87.75g=12.25g�������Ǧ��ˮ�����ʵ���֮��Ϊ$\frac{85.75g}{325g/mol}$��$\frac{12.25g}{18g/mol}$=1��3����n=3��
�ʴ�Ϊ��3��
��Ǧ������������Ϊ58.84�ˣ�����Ǧ�����ʵ���Ϊ=$\frac{85.75g}{325g/mol}$=$\frac{85.75}{325}$mol������Ǧԭ���غ㣬Ǧ�������PbOx�������ʵ���Ϊ$\frac{85.75}{325}$mol�����������Ħ������Ϊ$\frac{58.84g}{\frac{85.75}{325}mol}$=223g/mol��ΪPbO���л��������Ϊ85.75g-58.84g=26.91g�����л��������Ӧ�����ĸ�̼ԭ�ӣ����ʵ���Ϊ$\frac{85.75}{325}$mol��Ħ������=$\frac{26.91g}{\frac{85.75}{325}mol}$=102g/mol������ԭ���غ��֪�л���ķ���ʽΪC4H6O3���ʴ�Ϊ��C4H6O3��
��4��n��H+��=n��NaOH��=0.002500 mol•L-1��20.00mL��10-3L•mL-1=5.000��10-5mol
n[Pb2+��aq��]=$\frac{1}{2}$n��H+��=2.500��10-5mol
c��Pb2+��=$\frac{2.500��1{0}^{-5}mol}{25.00mL��1{0}^{-3}L/mL}$=1.000��10-3 mol•L-1
Ksp��PbI2��=c��Pb2+��•c2��I-��=4c3��Pb2+��=4����1.000��10-3��3=4.000��10-9��
��4.000��10-9��
��5����ȡPbI2����Һ������һ֧�Թ��У��ټ�������NaCl������Һ���γ�PbCl42-��������Һ��c��Pb2+����С��ƽ�������ƶ����⻯Ǧ�ܽ⣬���»�ɫ������ʧ��
����PbI2����Һ�е��뼸��FeCl3������Һ������������ԭ��ӦPbI2+2Fe3++4Cl-=PbCl42-+2Fe2++I2���⻯Ǧ�ܽ⣬���»�ɫ������ʧ���ʴ�Ϊ��
| ʵ������ | ʵ�鷽�� | ʵ������ԭ����� |
| ȡPbI2����Һ������һ֧�Թ��У��ټ�������NaCl������Һ | ����ɫ������ʧ ԭ���γ�PbCl42-��������Һ��c��Pb2+����С��ʹQcС��PbI2��Ksp | |
| PbI2+2Fe3++4Cl-=PbCl42-+2Fe2++I2 |
���� ���⿼���Ʊ�ʵ�鷽����ƣ�Ϊ��Ƶ���㣬�漰��Ӧ����Ӱ�����ء��������ܽ�ƽ�⡢������ԭ��Ӧ���ܶȻ������֪ʶ�㣬���ؿ���ѧ����������������ע�⣨2����5������йؼ���ͷ�����Ϊ�ѵ㣬ע������Ӻ��������ܷ���������ԭ��Ӧ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
��
 ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C4H8 | B�� | C5H12O | C�� | C5H11Br | D�� | ��C5H10O2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ���� | MgCl2 | Mg��OH��2 | MgCO3 |
| �ܽ�ȣ�g�� | 54.6 | 0.000 84 | 0.039 |
| A�� | ��֪MgCO3��Ksp=2.14��10-5 mol2•L-2�������к��й���MgCO3����Һ�У�����c��Mg2+��=c��CO32-������c��Mg2+��•c��CO32-��=2.14��10-5mol2•L-2 | |
| B�� | ��ȥ�����к��е�MgCl2���ʣ���ѳ����Լ�ΪNa2CO3��Һ | |
| C�� | �������ı��е��������ʷֱ�������ˮ��ϣ���ּ��ȡ����գ����յĹ��������ͬ | |
| D�� | ��ʯ��ˮ����ˮ�е�Mg2+��HCO3-�����������ӷ�Ӧ����ʽΪMg2++2HCO3-+Ca2++2OH-�TCaCO3��+MgCO3��+2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2 | B�� | 3 | C�� | 4 | D�� | 6 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com