
| ||
| ||


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
| A、X、Y、Z的稳定性逐渐增强 |
| B、X、Y、Z三种化合物的熔沸点逐渐升高 |
| C、A、B、C、D只能形成四种单质 |
| D、只含有A、B、C、D 四种元素的化合物有两种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠着火可用煤油扑灭 |
| B、将几滴FeCl3饱和溶液滴入氢氧化钠溶液可制备Fe(OH)3胶体 |
| C、向含有等量NaI、NaCl的溶液中滴加AgNO3溶液,先产生白色沉淀 |
| D、用浓氢氧化钠溶液和湿润红色石蕊试纸检验某溶液中是否有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
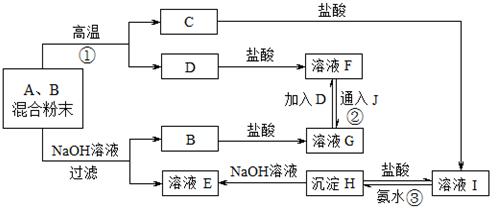
 的合成路线流程图(无机试剂任用).合成路线流程图如图:
的合成路线流程图(无机试剂任用).合成路线流程图如图:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com