
【题目】常见的太阳能电池有单晶硅或多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等。请回答下列问题:
(1)基态硒原子的价电子排布式为___;H2O的沸点高于H2Se的沸点(-42℃),其原因是___。
(2)已知GaCl3晶体熔点为77.9℃,沸点为201.3℃,GaCl3品体类型为____。
(3)Na3AsO4中阴离子的空间构型为_____,As原子采取_____杂化。
(4)高温下CuO容易转化为Cu2O,试从原子结构角度解释原因:_____。
(5)锌与铜位于同一周期。硫化锌的晶胞结构如图所示,S2-周围等距离且最近的Zn2+个数为____;若晶胞边长为dpm,则硫化锌的密度为____g·cm-3(不必简化)。

【答案】4s24p4 水分子之间存在氢键,H2Se分子之间不存在氢键 分子晶体 正四面体 sp3 Cu2O中Cu+价层电子排布处于稳定的全充满状态 4 ![]()
【解析】
(1)硒为34号元素,有6个价电子,所以硒的价层电子排布式为4s24p4;水分子之间存在氢键,H2Se分子之间不存在氢键,所以沸点高低:H2O>H2Se,故答案为:4s24p4;水分子之间存在氢键,H2Se分子之间不存在氢键;
(2)根据题中信息,GaCl3的熔点较低,GaCl3为分子晶体,故答案为:分子晶体;
(3)Na3AsO4中阴离子AsO43—,AsO43—中As原子价层电子对数为4,孤对电子数为0,所以As原子采取sp3杂化,AsO43—的空间构型为正四面体,故答案为:正四面体;sp3;
(4)原子轨道处于全空、半满或全满时最稳定,CuO中Cu2+的价层电子排布为3d9结构,而Cu2O中Cu+价层电子排布为全充满的3d10结构,更稳定,所以高温下CuO容易转化为Cu2O,故答案为:Cu2O中Cu+价层电子排布处于稳定的全充满状态;
(5)根据硫化锌晶胞结构图可知,每个Zn2+周围有4个S2-,每个S2-周围也有4个Zn2+;该晶胞中含有Zn2+数为8×![]() +6×
+6×![]() =4,含S2-数为4,则依据质量关系可得
=4,含S2-数为4,则依据质量关系可得![]() =(d×10-10cm)3ρ,则硫化锌的密度ρ=
=(d×10-10cm)3ρ,则硫化锌的密度ρ=![]() g·cm-3,故答案为:4;
g·cm-3,故答案为:4;![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】姜黄素具有抗突变和预防肿瘤的作用,其合成路线如下:

已知:
①1 mol G最多能消耗Na、NaOH、NaHCO3的物质的量分别为3 mol、2 mol、1 mol。
②![]()
③
(R1、R2、R3为烃基或氢原子)
请回答:
(1)B→C的反应类型是__________,写出反应的化学方程式______________________。
(2)C→D反应的化学方程式是_______________________________________________。
(3)E的核磁共振氢谱中有两个峰,E中含有的官能团名称是__________。
已知E→G的反应类型是加成反应,写出反应的化学方程式_____________________。
(4)下列有关香兰醛的叙述不正确的是__________。
a. 香兰醛能与NaHCO3溶液反应
b. 香兰醛能与浓溴水发生取代反应
c. 1 mol香兰醛最多能与3 mol H2发生加成反应
(5)写出所有符合下列条件的香兰醛的同分异构体的结构简式___________________。
①苯环上的一硝基取代物有2种
②遇Fe3+显紫色
③含有![]() 结构
结构
(6)姜黄素的分子中有2个甲基,其结构简式是__________。
(7)1,3—丙二醇是重要的化工物质,请设计由甲醇和乙醇(其他无机试剂任选)合成它的流程图,合成路线流程图示例如下:__________________________________
CH2=CH2 ![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的容器中进行反应N2(g)+3H2(g) ![]() 2NH3(g),若氮气浓度由0.1 mol·L-1降到0.06 mol·L-1需2 s,那么由0.06 mol·L-1降到0.024 mol·L-1需要的反应时间为
2NH3(g),若氮气浓度由0.1 mol·L-1降到0.06 mol·L-1需2 s,那么由0.06 mol·L-1降到0.024 mol·L-1需要的反应时间为
A. 等于1.8 s B. 等于1.2 s C. 大于1.8 s D. 小于1.8 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下 0.1mol/L的H2A溶液中H2A、HA-、A2-三者中所占物质的量分数(分布系数)随pH变化的关系如图所示。下列表述不正确的是

A. HA-![]() H+ + A2- K=10-4.2
H+ + A2- K=10-4.2
B. 在 0.1mol/L NaHA 溶液中,各离子浓度大小关系为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C. 已知25℃时HF的Ka=10-3.45,将少量H2A的溶液加入足量NaF溶液中,发生的反应为:H2A+F﹣═ HF+HA﹣
D. 将等物质的量的NaHA、Na2A溶于水中,所得溶液pH恰好为4.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。进行如下实验,下列有关说法正确的是( )
![]()
A.步骤I中减少的3g固体一定是混合物
B.步骤II中质量减少的物质一定是Cu
C.根据步骤I、II可以判断混合物X的成分为Al2O3、Fe2O3、Cu、SiO2
D.根据上述步骤II可以得出m(Fe2O3):m(Cu)=1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F是一种香料,其合成路线如图所示:

已知:i、
ii、
(1)A的名称为_____,F中的含氧官能团为_____(写名称)
(2)B的分子式为 C7H7Cl,步骤I的反应试剂和条件为______。
(3)步骤Ⅱ反应的化学方程式为______,反应类型为______。
(4)满足括号中条件(①苯环上只有两个取代基②能与FeCl3溶液发生显色反应③能发生水解反应和银镜反应)的E的同分异构体有____种,其中核磁共振氢谱峰面积比为6:2:2:1:1的分子的结构简式为_____。
(5)依据题中信息,完成以![]() 为原料制取试剂X
为原料制取试剂X 的合成路线图(无机试剂一定要选银氨溶液,其它无机试剂任选)_______。
的合成路线图(无机试剂一定要选银氨溶液,其它无机试剂任选)_______。
合成路线图示例如下:CH2=CH2 ![]() CH3CH2Br
CH3CH2Br ![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:
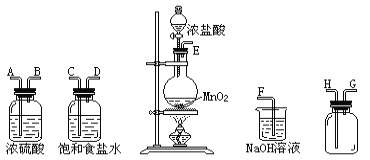
(1)连接上述仪器的正确顺序是:E接____,____接____,____接H,G接F。
(2)气体发生装置中进行的反应化学方程式是 ________;当足量的MnO2与2mol浓盐酸充分反应后(不考虑浓盐酸的挥发),得到的氯气的物质的量小于0.5mol的原因是__________。
(3)在装置中:①饱和食盐水的作用是______,②浓硫酸的作用是_____。
(4)化学实验中检验是否有Cl2产生常用_____,如果有Cl2产生,可观察到的现象是_________,写出反应方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探索CO2与CH4的反应使其转化为CO和H2,对减缓燃料危机,减少温室效应具有重要意义。回答下列问题
(1)已知:①CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206.1kJ·mol-1
CO(g)+3H2(g) △H1=+206.1kJ·mol-1
②2H2(g)+CO(g)![]() CH3OH(1) △H2=-128.3kJ·mol-1
CH3OH(1) △H2=-128.3kJ·mol-1
③2H2(g)+O2(g)![]() 2H2O(g) △H3=-483.6kJ·mol-1
2H2O(g) △H3=-483.6kJ·mol-1
25℃时,在合适的催化剂作用下,采用甲烷和氧气一步合成液态甲醇的热化学方程式为______________________。
(2)向某密闭恒容容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示。
2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示。

①工业生产时一般会选择在P4和1250℃条件下进行反应,请解释其原因______________________。
②在压强为P4、1100℃的条件下,该反应在5min时达到平衡点X,则0-5min内,用CO表示该反应平均速率为___________;该温度下,反应的平衡常数为___________(保留3位有效数字)。
(3)工业上用CO和H2制取甲醇反应方程式为2H2(g)+CO(g)![]() CH3OH(g)。对于该合成反应,若通入的CO的物质的量一定,如图为4种投料比[n(CO)︰n(H2)分别为5︰7、10︰17、5︰9、1︰2]时,反应温度对CO平衡转化率的影响曲线。
CH3OH(g)。对于该合成反应,若通入的CO的物质的量一定,如图为4种投料比[n(CO)︰n(H2)分别为5︰7、10︰17、5︰9、1︰2]时,反应温度对CO平衡转化率的影响曲线。

①曲线b对应的投料比是___________
②当反应在曲线a、b、c对应的投料比下达到相同的平衡转化率时,对应的反应温度和投料比的关系是___________。
③投料比为10︰17反应温度为T1时,平衡混合气体中CO的物质的量分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有主族元素A,B,C,D四种元素,原子序数依次递增,A元素原子2p轨道上有2个未成对电子。B原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大。C的最高化合价和最低化合价的代数和为4,其最高价氧化物中含C的质量分数为40%,且其核内质子数等于中子数。D原子得一个电子填入3p轨道后,3p轨道为全充满。
请回答下列问题:
(1)AC2分子中含有______个π键,属于________分子(填“极性”或“非极性”)。
(2)B的氢化物的立体构型为____________,B原子的原子轨道采用________杂化。
(3)写出A的常见氧化物与B的氧化物中互为等电子体的一组物质:_______________________________。
(4)C元素的电负性________D元素的电负性(填“>”、“<”或“=”);用一个化学方程式表示:_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com