
| A.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 |
| B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 |
| C.晶体中一定存在化学键 |
| D.正四面体分子中键角可能是109°28′或60° |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
| A.金属性:Na>K | B.非金属性:P>C1 |
| C.金属性:Al>Mg | D.非金属性:O>S |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.第一电离能:B<C<N<O | B.最高正价:F>O>N>C |
| C.电负性:O>C>Si>Na | D.半径:Na+>Cl- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
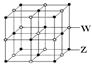
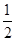 。下列说法正确的是
。下列说法正确的是| A.原子半径:W>Z>Y>X>M |
| B.XZ2、X2M2、W2Z2均为直线形共价化合物 |
| C.由X元素形成的单质不一定是原子晶体 |
| D.由Y、Z、M三种元素形成的化合物中只含有共价键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.极性键 | B.非极性键 | C.离子键 | D.配位键 E.氢键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
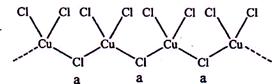
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.H2S | B.HCl | C.PH3 | D.SiH4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com