
 __7(��>,<��=),ԭ���� _______________________________________________________________________________
__7(��>,<��=),ԭ���� _______________________________________________________________________________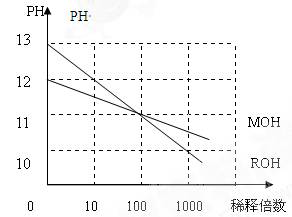

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��11 | B��5.5 | C��11.3 | D��10.7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��12 | B��13 | C��14 | D��15 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����֪��2H2(g)+O2(g)=2H2O(l)��H��0����Ӧ��������С�������������� |
| B���ⶨ������������Ʒ�Ӧ���к���ʵ���У������Լ�������Ũ��Һ |
| C��HCl��NaOH��Ӧ���к��Ȧ�H����57.3 kJ��mol��1����1molH2SO4��1molBa(OH)2��Ӧ�ų�������Ϊ114.6kJ |
| D����֪C(s)��CO(g)��ȼ���ȷֱ�Ϊ393.5kJ��mol-1 ��283.0kJ��mol-1������ͬ������C(s)��O2(g)��Ӧ����1molCO(g)�ķ�Ӧ��Ϊ��H����110.5kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
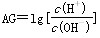 �� ���������������(����)
�� �����й������д������(����)| A������ʱ��������Һ��pH��7��AG��0 |
B��������Һ ��AG��0��AGԽ����Һ��pHԽС ��AG��0��AGԽ����Һ��pHԽС |
| C��������Һ��AG��0��AGԽ����Һ��pHԽ�� |
| D�������£�0.1 mol/LNaOH��Һ��AG����12��pH��13 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
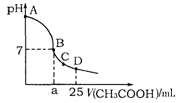
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��KOH | B��NH3��H2O | C��Ba(OH)2 | D��NaOH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��0.01mol/L | B��0.017mol/L | C��0.05mol/L | D��0.50mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 ʱ���ų�445KJ�������������Ȼ�ѧ����ʽ��ȷ����
ʱ���ų�445KJ�������������Ȼ�ѧ����ʽ��ȷ���� g)= 1/2CO2(g)
g)= 1/2CO2(g)  +H2O(l) ��H=-890KJ/mol
+H2O(l) ��H=-890KJ/mol�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com