
【题目】(1)①建筑上需要用到大量水泥、玻璃。生产水泥、玻璃中都用到的主要原料为_____(填字母)。
a. 纯碱 b. 石灰石 c. 黏土
②汽车工业大量使用橡胶轮胎,橡胶属于____________(填字母)。
a. 无机非金属材料 b. 金属材料 c. 有机高分子材料
③现代桥梁建造需要使用大量钢材,其中镀锌钢板镀锌的主要目的是_________ (填字母)。
a. 美化桥梁 b. 提高硬度 c. 提高耐腐蚀性
(2)洋蓟被人们冠以“蔬菜之皇”的美称,含有脂肪、蛋白质、糖类、维生素A、维生素C和丰富的钙、磷、铁等元素,其中:
①属于水溶性维生素的是_____________。
②属于人体所需微量元素的是_____________。
③脂肪在人体内水解生成高级脂肪酸和_____________________;糖类在人体中水解生成葡萄糖,写出葡萄糖在人体内氧化的化学方程式:________________________________________________。
(3)合理利用自然资源,防止环境污染和生态破坏。
①向燃煤中加入适量石灰石,可大大减少______________的排放。煤的气化是实现能源清洁化的重要途径,水煤气的主要成分是CO和_____________。
②明矾是一种常用的混凝剂,其净水原理是___________________________ (用离子方程式表示)。污水处理的方法很多,从化学角度看,处理酸性废水可采用________(选填“中和法”或“沉淀法”)。
③我国科学家证明了黄粉虫的幼虫可降解聚苯乙烯(![]() )这类难以自然降解的塑料。请写出由苯乙烯合成聚苯乙烯的化学方程式:__________________________________________。
)这类难以自然降解的塑料。请写出由苯乙烯合成聚苯乙烯的化学方程式:__________________________________________。
【答案】b c c 维生素C Fe 甘油 C6H12O6+6O2![]() 6CO2+6H2O SO2 H2 Al3++3H2O
6CO2+6H2O SO2 H2 Al3++3H2O ![]() Al(OH)3(胶体)+3H+ 中和法 n
Al(OH)3(胶体)+3H+ 中和法 n![]()
![]()
![]()
【解析】
(1)①生产水泥的原料是粘土和石灰石,生产玻璃的原料是纯碱、石灰石和石英;②材料分为金属材料、无机非金属材料、复合材料、有机高分子材料,利用题干提供的信息判断;③在原电池的正极金属可以被保护;
(2)①维生素A属于脂溶性维生素,维生素C为水溶性维生素;②人体中的常量元素主要有:氧、碳、氢、氮、钙、磷、钾、硫、钠、氯、镁;微量元素主要有:铁、钴、铜、锌、铬、锰、钼、氟、碘、硒;③脂肪在人体内水解的产物是高级脂肪酸和甘油;葡萄糖发生缓慢氧化反应生成二氧化碳和水;
(3)①向煤中加入石灰石作为脱硫剂,可以减少SO2的排放;水煤气的主要成分是一氧化碳和氢气;②明矾可水解生成具有吸附性的氢氧化铝胶体;③一定条件下,苯乙烯发生加成聚合反应生成聚苯乙烯。
据此分析解答。
(1)①制造水泥的原料是粘土和石灰石,制造玻璃的原料是纯碱、石灰石和石英,工业上制造水泥、玻璃和高炉炼铁都要用到的原料是石灰石,故答案为:b;
②天然橡胶是天然存在的有机高分子化合物,合成橡胶是人工合成的有机高分子化合物,因此橡胶属于有机高分子材料,故答案为:c;
③钢板镀锌形成的原电池中,金属铁为正极,可以防止锈蚀,所以钢板镀锌的主要目的是提高耐腐蚀性,故答案为:c;
(2)①维生素可分为脂溶性维生素和水溶性维生素两类,脂溶性维生素包括维生素A、维生素D、维生素E、维生素K等,水溶性维生素溶于水,有B族维生素和维生素C,故答案为:维生素C;
②人体中的常量元素主要有:氧、碳、氢、氮、钙、磷、钾、硫、钠、氯、镁;微量元素主要有:铁、钴、铜、锌、铬、锰、钼、氟、碘、硒等,故洋蓟中所含的人体所需的微量元素有铁,故答案为:Fe;
③脂肪在人体内水解的产物是高级脂肪酸和甘油,葡萄糖发生缓慢氧化反应生成二氧化碳和水,产生能量,反应的化学方程式为:C6H12O6+6O2 ![]() 6CO2+6H2O,故答案为:甘油;C6H12O6+6O2
6CO2+6H2O,故答案为:甘油;C6H12O6+6O2 ![]() 6CO2+6H2O。
6CO2+6H2O。
(3)①向煤中加入石灰石作为脱硫剂,可以减少SO2的排放,生成CaSO4;水煤气的主要成分是CO和H2,故答案为:SO2;H2;
②水在净化处理过程中加入明矾做混凝剂,因明矾水解生成具有吸附性的胶体,反应的离子方程式为Al3++3H2OAl(OH)3(胶体)+3H+;处理酸性废水可采用碱与酸发生中和反应,即中和法处理,故答案为:Al3++3H2OAl(OH)3(胶体)+3H+;中和法;
③一定条件下,苯乙烯发生聚合反应生成聚苯乙烯,反应方程式为:n![]() -CH=CH2
-CH=CH2![]()
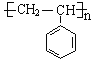 ,故答案为:n
,故答案为:n![]() -CH=CH2
-CH=CH2![]()
 。
。


科目:高中化学 来源: 题型:
【题目】现用物质的量浓度为0.100 0 mol·L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:

(1)用标准NaOH溶液滴定时,应将标准NaOH溶液注入_______(填“甲”或“乙”)中。
(2)某学生的操作步骤如下:
A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴部分充满溶液;
D.取标准NaOH溶液注入碱式滴定管至“0”刻度以上 2~3 mL;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是____→___→___→___→A→___(用字母序号填写)。判断到达滴定终点的实验现象是_____________________________________
(3)右上图是碱式滴定管中液面在滴定前后的读数, c(HCl)=_______ mol·L-1。
(4)由于错误操作,使得上述所测盐酸溶液的浓度偏高的是________(填字母)。
A.中和滴定达终点时俯视滴定管内液面读数
B.酸式滴定管用蒸馏水洗净后立即取用25.00 mL待测酸溶液注入锥形瓶进行滴定
C.碱式滴定管用蒸馏水洗净后立即装标准溶液来滴定
D.用酸式滴定管量取待测盐酸时,取液前有气泡,取液后无气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家将水置于足够强的电场中,在20℃时水分子瞬间凝固可形成“暖冰”。某兴趣小组做如图所示实验,发现烧杯中酸性KMnO4溶液褪色,且有气泡产生。将酸性KMnO4溶液换成FeCl3溶液,烧杯中溶液颜色无变化,但有气泡产生。则下列说法中正确的是( )

A. 20℃时,水凝固形成的“暖冰”所发生的变化是化学变化
B. “暖冰”是水置于足够强的电场中形成的混合物
C. 烧杯中液体为FeCl3溶液时,产生的气体为Cl2
D. 该条件下H2燃烧的产物中可能含有一定量的H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的由Cu和Cu2O组成的混合粉末加入到125 mL 2.6 mol·L-1的稀硝酸中,固体完全溶解,得蓝色溶液X并收集到V mL(标准状况)的纯净无色气体Y。下列结论错误的是
A. 纯净无色气体Y与0.75VmL(标准状况)O2混合后通入水中,气体可被完全吸收
B. 若固体与硝酸恰好完全反应,当V=1680时,Cu2O与Cu的物质的量之比为8∶1
C. 原混合粉末的总质量可能为9.8 g
D. 向溶液中加入NaOH溶液,使Cu2+恰好完全沉淀,消耗NaOH的物质的量为(0.325-V/22400)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国夏威夷联合天文中心的科学家发现了新的氢微粒,该微粒是由3个氢原子核(只含质子)和2个电子构成,关于这种微粒的下列说法中正确的是
A. 是氢元素的一种新的同素异形体
B. 是氢元素的一种新的同位素
C. 该微粒的组成可用H3表示
D. 该微粒比普通氢分子多一个氢原子核
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是元素周期表中原子序数依次增大的前四周期元素。A与B同周期,且A元素原子核外s能级有1个未成对电子;C元素的原子序数比B多1,且C元素的原子核外p电子比s电子少1;D元素的原子价电子有6个未成对电子,它的一种化合物常用于检验酒驾;E元素的原子序数为27。请回答下列问题:
(1)第一电离能介于A和C之间的同周期元素有________________(填元素符号)。
(2)C元素的最高价氧化物所对应的水化物在水溶液中能完全电离,电离所得阴离子的空间构型为__________________,写出任意一种与该阴离子互为等电子体的微粒的化学式_______________。
(3)与B元素同主族的元素硅,其四卤化物的沸点和铅的二卤化物熔点如图所示:

①SiX4的沸点依F、Cl、Br、I次序升高的原因是_________________________。
②结合SiX4的沸点和PbX2的熔点的变化规律,可推断:依F、Cl、Br、I次序,PbX2中化学键的离子性逐渐_____________(填“增强”、“不变”或“减弱”)。
(4)①元素D的+6价橙红色氧化物常用于检验酒驾,其在酸性条件下遇到乙醇会反应生成绿色的D3+离子,同时乙醇转化为一种无毒气体。请写出该反应的离子反应方程式____________________。
②元素D可以形成如图所示的配合物,该配合物中所含化学键的类型不包括________(填字母)。

a 极性共价键 b 非极性共价键 c 配位键 d 离子键 e 金属键 f σ键 g Π键
(5)已知E3+可形成配位数为6的配合物。现有橙黄色和紫红色两种E的配合物,其组成均可表示为ECl3·nNH3。为测定这两种配合物晶体的化学式,设计了如下实验:
a.分别取等质量的两种晶体的样品配成溶液;
b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤,经洗涤干燥后称量,发现紫红色晶体产生沉淀的质量与橙黄色晶体产生沉淀的质量之比为2:3 。则紫红色晶体的化学式为______________(用配合物的形式写出化学式,且E用元素符号表示,n用具体数字表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,将agNH3完全溶于水,得到VmL溶液,设该溶液的密度为ρg·cm-3,质量分数为ω,其中含NH4+的物质的量为bmol。下列叙述中不正确的是
A.溶质的质量分数ω=![]() ×100%
×100%
B.溶质的物质的量浓度c=1000a/17Vmol·L-1
C.溶液中c(OH-)=1000b/Vmol·L-1+c(H+)
D.上述溶液中再加入VmL水后,所得溶液中溶质的质量分数小于0.5ω
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com