
如图所示,分别向密闭容器内可移动活塞的两边充入空气,H2和O2的混合气体(空气占整个装置体积的1/4),在标准状况下,若将H2、O2的混合气体点燃引爆。活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央。则原来H2、O2的体积之比可能为

A.2∶7 B.5∶4 C.2∶1 D.7∶2
科目:高中化学 来源:2015-2016学年福建省高一上学期期中测试化学试卷(解析版) 题型:选择题
下列根据实验现象所得出的结论中,一定正确的是
A、无色试液加入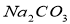 溶液产生白色沉淀,结论:试液中含
溶液产生白色沉淀,结论:试液中含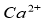
B、无色试液加入KOH溶液,加热产生的气体使红色石蕊试纸变蓝,结论:试液中含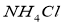
C、无色试液使红色石蕊试纸变蓝,结论:试液呈碱性
D、无色试液焰色反应呈紫色,结论:试液是钾盐溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二上学期期中测试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数,下列说法不正确的是
A.18gH2O中含有的电子数为10 NA
B.46gNO2和46gN2O4含有的原子数均为3 NA
C.1L 1mol·L-1的盐酸中,所含HCl分子数为NA
D.标准状况下,11.2L O3中含1.5 NA个氧原子
查看答案和解析>>
科目:高中化学 来源:2016届河南省高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列叙述不正确的是
A,10mL质量分数为98%的H2SO4用10mL水稀释后;H2SO4的质量分数大于49%
B.配制0.1 mol·L-1的Na2CO3溶液480mL,需用500ml容量瓶
C.在标准状况下,将22.4L氨气溶于1L水中,得到1mol·L-1的氨水
D.向2等份不饱和的烧碱溶液中分别加入一定量的Na2O2和Na2O,使溶液均恰好饱和,则加入的Na2O2与Na2O的物质的量之比等于1:1(保持温度不变)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高二上学期期中测试化学试卷(解析版) 题型:选择题
某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g) 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
A、m=2
B、加入1molZ(g)时,平衡逆向移动,达到平衡后反应物的转化率减小
C、X与Y的平衡转化率之比为1:1
D、第二次平衡时,Z的浓度为0.2mol·L-1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省淄博市高二上学期期中测试化学试卷(解析版) 题型:选择题
某温度时,浓度都是1mol·L-1的两种气体,X2、Y2在密闭容器中反应生成气体Z,达到平衡时c(X2)=0.4mol·L-1、c(Y2)=0.8mol·L-1、c(C)=0.4mol·L-1,则该反应的反应式是
A.X2+2Y2  XY2 B.2X2+Y2
XY2 B.2X2+Y2  2X2Y
2X2Y
C.3X2+Y2  2X3Y D.X2+3Y2
2X3Y D.X2+3Y2  2XY3
2XY3
查看答案和解析>>
科目:高中化学 来源:2016届福建省厦门市高三上学期期中测试化学试卷(解析版) 题型:选择题
利用食盐水制取ClO2的工业流程如右图所示,

装置①中的反应:NaCl+3H2O NaClO3+3H2↑
NaClO3+3H2↑
装置②中的反应:2NaClO3+4HCl ClO2+ Cl2↑+2NaCl+2H2O。
ClO2+ Cl2↑+2NaCl+2H2O。
下列关于该流程说法不正确的是
A.该流程中Cl2、NaCl都可以循环利用
B.装置①中H2是阴极产物
C.装置②发生的反应中,Cl2是氧化产物,NaCl是还原产物
D.为了使H2完全转化为HCl,需要向装置③中补充Cl2
查看答案和解析>>
科目:高中化学 来源:2016届湖北省枣阳市高三上学期10月月考理综化学试卷(解析版) 题型:推断题
X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为 、 ;
(2)XZ2与YZ2分子的立体结构分别是 和 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 ;
(3)Q的元素符号是 ,它属于第 周期,它的核外电子排布式为 ,在形成化合物时它的最高化合价为 ;
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键 。
查看答案和解析>>
科目:高中化学 来源:2016届山东省临沂市高三上学期10月阶段性教学质检化学试卷(解析版) 题型:实验题
草酸亚铁晶体(FeC2O4·2H2O)呈淡黄色。某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究。
(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到二氧化碳气体生成。这说明草酸亚铁晶体具有 (填“氧化性”、“还原性”或“碱性”)。若反应中消耗1 mol FeC2O4·2H2O,则参加反应的KMnO4为 mol。
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体。课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO假设二: 假设三:
(3)为验证上述假设一是否成立,课题组进行如下研究。
【定性研究】请你完成下表中内容。
实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
取少量黑色固体, |
【定量研究】课题组在文献中查阅到,FeC2O4·2H2O受热分解时,固体质量随温度变化的曲线如右图所示,写出加热到400℃时,FeC2O4·2H2O晶体受热分解得到的固体产物的化学式为: 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com