
【题目】下列各组离子在给定条件下一定能大量共存的是
A. 强酸性溶液中:H+、NO3-、SO32-
B. pH=12的溶液中:OH-、K+、Cl-、HCO3-
C. 加入铝粉能放出氢气的溶液中一定存在:NH4+、NO3-、AlO2-、SO42-
D. 25C时pH=7的无色溶液中:Na+、Cl-、SO42-、K+
科目:高中化学 来源: 题型:
【题目】回答下列各题:
(1)用电子式表示H2O和MgBr2的形成过程:H2O_____;MgBr2______.
(2)写出CO2、Na2O2的电子式:CO2_______、Na2O2______.
(3)A+、B+、C-、D、E 5种粒子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:
①A++C-→D+E:②B++C-→2D。据此,写出①反应的离子方程式________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年11月,河南省环境监测中心基于卫星遥感数据共监测到秸秆焚烧火点 29个,秸秆燃烧后的草木灰的主要成分是碳酸押,还含有少量的硫酸钾,氯化钾和部分难溶物。某实验中学对秸秆燃烧后的草木灰中的成分进行了探究。

(1)上述流程中操作II为_____(填“过滤”或“分液"),操作Ⅲ中需要使用玻璃棒,其作用为_____。
(2)白色沉淀中所含物质的化学式:________。写出生成此沉淀的化学方程式:_____;____。
(3)下列关于洁秆燃烧的说法不合理的是______
A.焚烧粘秆极易引燃周围的易燃物从而引发火灾
B.焚烧秸秆形成的烟雾,会造成空气能见度下降,进而引发交通事故,影响道路交通和航空安全
C.秸杆燃烧会产生钾肥,可以广泛推广,大力支持就地焚烧秸秆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物A经李比希法测得其中含碳为70.59%、含氢为 5.88%,其余含有氧。现用下列方法测定该有机化合物的相对分子质量和分子结构。
方法一:用质谱法分析得知A的相对分子质量为136。
方法二:核磁共振仪测出A的核磁共振氢谱有4个峰,其面积之比为1∶2∶2∶3。如下图。
方法三:利用红外光谱仪测得A分子的红外光谱,如下图。

(1)分子中共有____种化学环境不同的氢原子。
(2)A的分子式为____。
(3)该物质属于哪一类有机物____。
(4)A的分子中只含一个甲基的依据是____(填序号)。
a.A的相对分子质量 b.A的分子式 c.A的核磁共振氢谱图 d.A分子的红外光谱图
(5)A的结构简式为____________________________________________。
(6)A的芳香类同分异构体有多种,其中又同时符合下列条件:①属于酯类;②分子结构中含有一个甲基。则该芳香类A的同分异构体共有___种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 自发反应的熵一定增大,非自发反应的熵一定减小
B. 吸热的熵增加反应一定能自发进行
C. 反应2Mg(s)+CO2(g)===C(s)+2MgO(s)能自发进行,则该反应的ΔH>0
D. 常温下,反应C(s)+CO2(g)![]() 2CO(g)不能自发进行,则该反应的ΔH>0
2CO(g)不能自发进行,则该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铈(Ce)是一种重要的稀土元素。以富含CeO2的废玻璃粉末(含SiO2、 Fe2O3以及其他少量可溶于稀酸的杂质)为原料,采用多种方法回收铈。请回答下列问题:
(1)湿法空气氧化法回收铈的部分流程如下:(已知:CeO2不溶于稀盐酸,也不溶于NaOH溶液。)
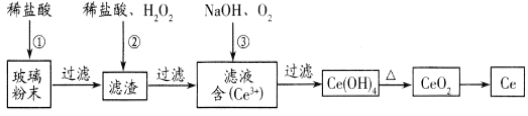
滤渣的成分是_____________________,反应②的离子方程式是_____________________________。
(2)干法空气氧化法回收铈是把Ce(OH)3被空气氧化成Ce(OH)4,氧化过程中发生的化学反应方程式为___________________________。
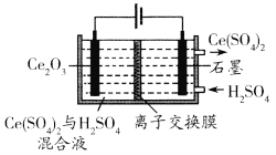
(3)利用电解方法也可以实现铈的回收。在酸性条件下电解Ce2O3(如图):阳极电极反应式为________________,离子交换膜为________ (填“阴”或“阳”)离子交换膜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3.6g H2O的物质的量是______,含有______个水分子,含有______mol H;12.4gNa2R含Na+0.4mol,则Na2R的摩尔质量为______,R的相对原子质量为______。含R的质量为1.6g的Na2R,其物质的量为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
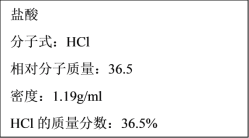
(1)该浓盐酸的物质的量浓度为___mol·L-1。
(2)某学生欲用上述浓盐酸和蒸馏水配制500ml物质的量浓度为0.4mol·L-1的稀盐酸,该学生需用量筒量取___ml上述浓盐酸进行配制。
(3)实验室用盐酸的浓溶液与高锰酸钾发生反应的化学方程式为:2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O,该反应中的氧化剂是___,还原剂是___。(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
Ⅰ.(1)下列措施中可以使0.10mol·L-1 CH3COOH溶液的电离程度增大的是__________(填序号)。
a.加入少量0.10mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010mol·L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)__________V(醋酸)(填">" "<"或“=”)。
(3)某温度下,Kw=1×10-12,将 0.02mol·L-1 的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH =__________。
Ⅱ.实验表明,液态时纯硫酸的电离能力强于纯硝酸,纯硫酸的导电性也显著强于纯水。又知液态纯酸都像水那样进行自身电离(H2O+H2O![]() H3O++OH-)而建立平衡,且在一定温度下都有各自的离子积常数。据此回答:
H3O++OH-)而建立平衡,且在一定温度下都有各自的离子积常数。据此回答:
(1)纯硫酸在液态时自身电离的方程式是__________
(2)25℃时,液态纯硫酸的离子积常数K(H2SO4)__________(填“>”“<”或“=”)1×10-14
(3)在纯硫酸与纯硝酸的液态混合酸中,存在的阴离子主要是__________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com