

| A. | 冰毒的摩尔质量为149 | |
| B. | 海洛因和杜冷丁均能与溴水发生加成反应 | |
| C. | 1mol可卡因最多能与2molNaOH发生反应 | |
| D. | 以上毒品均属于芳香烃 |
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 石英玻璃是以纯碱、石灰石和二氧化硅为原料制成的 | |
| B. | 氮的固定是指将空气中游离的氮转变为氮的化合物的方法 | |
| C. | 绿色食品是指不含任何化学物质的食品 | |
| D. | 纳米材料是指一种称为“纳米”的新物质制成的材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 选用试剂(填序号) | 实验现象 | |
| 方案1 | ||
| 方案2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
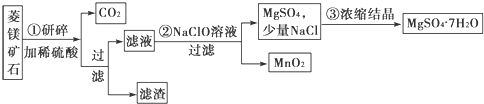
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
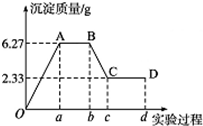 下面是某化学研究性学习小组对某无色水样成分的检验过程,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag +、Ca2+、Cl-、CO32-和SO42-中的若干种,该小组同学取100mL水样进行实验:向样品中先滴加硝酸钡溶液,再滴加1.0mol•L-1的硝酸,实验过程中沉淀质量的变化如图所示:
下面是某化学研究性学习小组对某无色水样成分的检验过程,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag +、Ca2+、Cl-、CO32-和SO42-中的若干种,该小组同学取100mL水样进行实验:向样品中先滴加硝酸钡溶液,再滴加1.0mol•L-1的硝酸,实验过程中沉淀质量的变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
.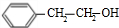 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2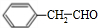 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L的H2O2中所含H原子个数远大于2NA | |
| B. | 常温常压下,14.2g的Na2SO4和Na2S2O3的混合物含有Na原子个数为0.4NA | |
| C. | 标准状况下,130.5g的MnO2粉末与足量浓盐酸共热转移电子数目小于3NA | |
| D. | 常温常压下,足量的金属Al与1mol Cl2共热,转移电子数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com