
分析 (1)金属铁失电子化合价升高,元素的化合价降低,得到电子,化合价降低元素所在的反应物是氧化剂;
(2)根据电子守恒进行计算即可;
(3)根据电子守恒以及元素化合价升降之间的关系来配平方程式.
解答 解:(1)金属铁失电子化合价升高,根据物质的化合价变化分析,只能是NaNO2中的N元素的化合价降低,所以NaNO2是氧化剂,故答案为:NaNO2;
(2)NaNO2中的N元素的化合价降低,降低了6价,所以产生1mol氨气得到电子是6mol,若反应转移了0.3mol电子,则生成的氨气物质的量是
在标准状况下的体积是0.05mol,标况下的体积是:0.05mol×22.4L/mol=1.12L,故答案为:1.12;
(3)Fe→Na2FeO2金属铁失电子化合价升高了2价,NaNO2→NH3其中的N得电子,化合价降低了6价,根据电子守恒,所以Fe元素前边系数是3,结合元素守恒,得到方程式:3Fe+NaNO2+5NaOH→3Na2FeO2+NH3+H2O,故答案为:3Fe+NaNO2+5NaOH→3Na2FeO2+NH3+H2O.
点评 本题考查了氧化还原知识,熟悉氧化还原反应相关概念及规律是解题关键,题目难度不大.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
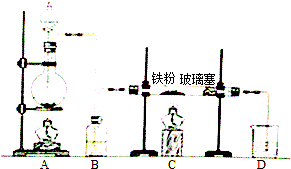 计算:
计算:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+ | B. | NH4+和Fe2+ | C. | Al3+和Mg2+ | D. | Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
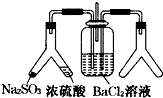
| A. | 只有①② | B. | 只有③⑤ | C. | 只有①②③ | D. | 只有①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c1=1mol•L-1 | B. | 2c1>c2 | C. | 2ω1<ω2 | D. | $\frac{{c}_{1}}{{ω}_{1}}$<$\frac{{c}_{2}}{{ω}_{2}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、K+、SO42-、OH- | B. | Ba2+、K+、Cl-、CO32- | ||
| C. | Cu2+、Ba2+、Cl-、NO3- | D. | Fe2+、H+、SO42-、MnO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
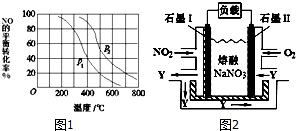
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com