
| A、HNO3 |
| B、C2H5OH |
| C、NH4NO3 |
| D、SO2 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、电解熔融氢氧化钠制钠,阴极发生电极反应为:Na++e-=Na |
| B、盖?吕萨克法制钠原理是利用铁的还原性比钠强 |
| C、若戴维法与盖?吕萨克法制得等量的钠,则两反应中转移的电子总数比为1:2 |
D、目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极,铁为阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硝酸钠晶体 |
| B、豆浆 |
| C、Fe (OH)3胶体 |
| D、75%的酒精溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 氢氧化钠溶液 |
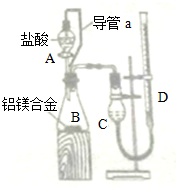
| 盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 稀H2SO4 |
| △ |
| 一定条件 |
| (Ⅰ)浓H2SO4 |
| 170℃ |
| 试剂X |
| (Ⅱ) |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl-、Fe3+、NO3-、OH- |
| B、HCO3-、Cl-、Na+、H+ |
| C、Ba2+、Cl-、NO3-、K+ |
| D、NH4+、K+、OH-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、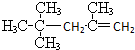 的名称为2,2,4-三甲基戊烯 的名称为2,2,4-三甲基戊烯 |
B、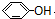 、 、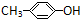 和 和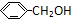 互为同系物 互为同系物 |
| C、CH≡CCH2CH3的所有碳原子在一条直线上 |
D、HCHO和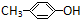 在一定条件下能发生缩聚反应生成 在一定条件下能发生缩聚反应生成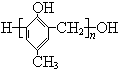 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com