
【题目】亚砷酸(H3AsO3)可用于白血病的治疗。室温下,配制一组c(H3AsO3)+c(H2AsO3-)+c(HAsO32-)+c(AsO33-)=0.100 mol·L-1的H3AsO3和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化关系曲线如图所示。下列指定溶液中微粒的物质的量浓度关系正确的是( )

A.pH=11的溶液中:c(HAsO32-)+c(AsO33-)>c(H2AsO3-)
B.c(Na+)=0.100 mol·L-1的溶液中:c(H2AsO3-)>c(H3AsO3)>c(HAsO32-)
C.c(Na+)=0.200 mol·L-1的溶液中:c(H+)+2c(H3AsO3)=c(OH-)+c(AsO33-)
D.pH=12.8的溶液中:c(H+)+c(Na+)>4c(H2AsO3-)+c(HAsO32-)+c(OH-)
【答案】BD
【解析】
H3AsO3、H2AsO3-、HAsO32-、AsO33-存在于同一溶液中,说明H3AsO3是三元弱酸,溶液中存在电荷守恒:c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(OH-)=c(H+)+c(Na+),据此解答。
A.由图可知,pH=11时,c(HAsO32-)+c(AsO33-)<c(H2AsO3-),A错误;
B.c(H3AsO3)+c(H2AsO3-)+c(HAsO32-)+c(AsO33-)=0.100 mol·L-1,c(Na+)=0.100 mol·L-1,即c(H3AsO3)+c(H2AsO3-)+c(HAsO32-)+c(AsO33-)= c(Na+),此等式为NaH2AsO3的物料守恒,则c(H2AsO3-)、c(H3AsO3)、c(HAsO32-)中,c(H2AsO3-)最大,由图可知:c(H2AsO3-)大于c(H3AsO3)、c(HAsO32-)时,溶液显碱性,即H2AsO3-的水解程度大于电离程度,故c(H3AsO3)>c(HAsO32-),所以,c(H2AsO3-)>c(H3AsO3)>c(HAsO32-),B正确;
C.c(Na+)=0.200 mol·L-1,c(H3AsO3)+c(H2AsO3-)+c(HAsO32-)+c(AsO33-)=0.100 mol·L-1,即2[c(H3AsO3)+c(H2AsO3-)+c(HAsO32-)+c(AsO33-)]=c(Na+),又因为电荷守恒:c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(OH-)=c(H+)+c(Na+),所以,c(H+)+c(H2AsO3-)+2c(H3AsO3)=c(OH-)+c(AsO33-),C错误;
D.电荷守恒:c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(OH-)=c(H+)+c(Na+),由图可知,pH=12.8时,c(H2AsO3-)=c(AsO33-),所以,4c(H2AsO3-)+2c(HAsO32-)+c(OH-)=c(H+)+c(Na+),所以,c(H+)+c(Na+)>4c(H2AsO3-)+c(HAsO32-)+c(OH-),D正确。
答案选BD。


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】中华人民共和国国家标准(G2762011)规定葡萄酒中c最大使用量为0.25g/L.某兴趣小组用图装置(夹持装置略)收集某葡萄酒中SO2,并对含量进行测定。
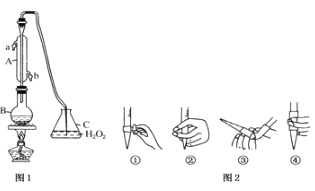
(1)仪器A的名称是________,水通入A的进口为_______________
(2)B中加入300.0ml葡萄酒和适量盐酸,加热使SO2全部逸出与C中H2O2完全反应其化学方程式为_________________________________
(3)除去C中过量的H2O2,然后用0.0900mol/LNaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的________;若滴定终点时溶液的pH=8.8,则选择的指示剂为________;若用50mL滴定管进行实验,当滴定管中的液面在刻度“20”处,则管内液体的体积______(填序号)
(①=20mL,②=30mL,③<20mL,④>30mL).
(4)滴定至终点时,消耗NaOH溶液12.50mL,该葡萄酒中SO2含量为:___g/L
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案合理的是________
A.配制银氨溶液:在一定量![]() 溶液中,滴加氨水至沉淀恰好溶解
溶液中,滴加氨水至沉淀恰好溶解
B.检验RX中的卤素原子,把RX与烧碱水溶液混合加热后,将溶液冷却再加入硝酸银溶液
C.无水乙醇和浓硫酸共热至170℃,将制得的气体通入酸性高锰酸钾溶液,可检验制得的气体是否为乙烯
D.实验室制取乙烯时,必须将温度计的水银球插入反应液中,测定反应液的温度
E.乙烷中混有乙烯,通过氢气在一定条件下反应,使乙烯转化为乙烷
F.用氨水清洗做过银镜反应的试管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧磷酸亚铁锂正极材料(主要成分为LiFePO4,含炭黑、铝等杂质)为原料可制备LiOH溶液和FePO4。
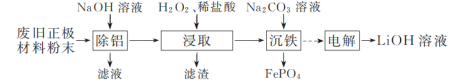
(1)“除铝”时反应的离子方程式为______________________________。
(2)试从沉淀溶解平衡移动的角度解释“浸取时加入H2O2、稀盐酸”可促进LiFePO4溶解的原因:______。
(3)“浸取”所得滤液中,磷元素的存在形式主要是________(填字母)。
a. PO![]() b. H3PO4 c. H2PO
b. H3PO4 c. H2PO![]()
(4)“沉铁”时铁、磷的沉淀率随溶液pH的变化如图1所示。pH>2.5后磷元素的沉淀率逐渐下降,原因是_____________________。
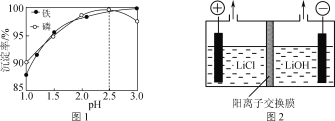
(5)“电解”制备LiOH的原理如图2所示,装置中使用阳离子交换膜将电解槽隔成阳极室和阴极室的目的是________________________________________。
(6)LiOH和(NH4)2Fe(SO4)2、H3PO4反应得到LiFePO4、NH4HSO4。写出该反应的化学方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于A2(g)+3B2(g)![]() 2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
A. v(A2)=0.8 mol·L-1·s-1 B. v(A2)=30 mol·L-1·min-1
C. v(AB3)=1.0 mol·L-1·s-1 D. v(B2)=1.2 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁-空气电池的总反应方程式为:2Mg+O2+2H2O=2Mg(OH)2,其工作原理如图所示,下列说法不正确是
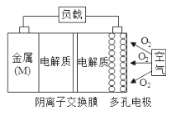
A.该电池的正极反应方程式为O2+4e-+2H2O=4OH-
B.为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
C.该电池中电子从金属电极流出,流经电解质到多孔电极
D.采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的有几项( )
①热稳定性:Na2CO3>NaHCO3
②常温时在水中的溶解度:NaHCO3<Na2CO3
③Na2CO3不能转化成NaHCO3,而NaHCO3能转化成Na2CO3
④NaHCO3加热至200℃左右,可完全分解,利用这种性质,可由NaHCO3制取纯碱
⑤当NaHCO3与Na2CO3质量相同时,分别跟足量盐酸反应,NaHCO3可得到较多的二氧化碳
⑥Na2CO3·10H2O在空气中会风化
⑦某物质焰色反应呈黄色,该物质一定是钠盐
A.4B.5C.6D.7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3。Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用该原理处理污水,设计装置如图所示。下列说法正确的是
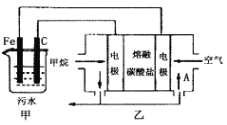
A.为了增加污水的导电能力,应向污水中加入适量的H2SO4溶液
B.甲装置中Fe电极的反应为Fe-3e-=Fe3+
C.当乙装置中有1.6gCH4参加反应,则C电极理论上生成气体体积为4.48L
D.为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A. B.
B.
C. D.
D.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com