
【题目】古埃及人在公元前一千多年前曾用橄榄石(硅酸盐)作饰品,称它为“太阳的宝石”。某小组以某橄榄石(主要成分可看作为MgO、FeO和SiO2,还含有少量的MnO等)为原料制备工业合成氨的活性催化剂(FeO和Fe2O3质量比为9:20的混合物)的一种流程如下:

金属离子生成氢氧化物沉淀的pH如下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Mg2+ | 7.6 | 9.4 |
Fe2+ | 6.5 | 9.9 |
Fe3+ | 1.5 | 3.3 |
Mn2+ | 8.2 | 10.6 |
回答以下问题:
(1)从绿色化学角度分析,试剂1宜选择___(填字母)。加入试剂1的目的是___(用离子方程式表示)。
a.H2O2 b.MnO2 c.HNO3 d.K2Cr2O7
(2)调节pH范围为___。
(3)单位时间内“酸浸”中金属浸出率与温度、盐酸浓度的关系如图所示。

x___(填“>”“<”或“=”)2。当盐酸浓度相同时,温度高于45℃,浸出率降低的主要原因是___。
(4)“还原”过程中,不仅要控制温度,而且要控制氧化铁和炭粉(C)的比例。若“还原”时产生气体的相对分子质量为36,理论上,480kgFe2O3需要加入___kg炭粉(C)。
【答案】a 2Fe2++H2O2+2H+=2Fe3++2H2O 3.3≤pH<7.6 > 温度过高,加快盐酸挥发,盐酸浓度降低较快 8
【解析】
橄榄石中加入过量盐酸后过滤所得滤液A中含有氯化镁、氯化亚铁、氯化锰等,加入试剂1将氯化亚铁氧化为氯化铁,调节溶液的pH使铁离子完全沉淀,过滤所得滤渣2为氢氧化铁,灼烧可得氧化铁,加入碳粉还原可得催化剂,由此进行分析作答。
(1)加入试剂1的目的是将氯化亚铁氧化为氯化铁,为了不引入新的杂质,试剂1宜选择H2O2,发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;
(2)调节溶液的pH使铁离子完全沉淀,而镁离子不沉淀,则调节pH范围为3.3≤pH<7.6;
(3)盐酸浓度越大,金属的浸出率越高,则x>2;当盐酸浓度相同时,温度过高,加快盐酸挥发,盐酸浓度降低较快,浸出率降低;
(4)FeO与Fe2O3的质量之比为9:20,FeO与Fe2O3的物质的量之比为![]() =1:1,480 kgFe2O3的物质的量为3×103mol设有xmolFe2O3参与反应
=1:1,480 kgFe2O3的物质的量为3×103mol设有xmolFe2O3参与反应
3Fe2O3+2C![]() 6FeO+CO2↑+CO↑
6FeO+CO2↑+CO↑
![]()
![]()
剩余Fe2O3的物质的量为3×103mol –xmol,那么![]() ,解得x=10-3mol,参与反的氧化铁为160kg,
,解得x=10-3mol,参与反的氧化铁为160kg,
3Fe2O3 + 2C ![]() 6FeO+CO2↑+CO↑
6FeO+CO2↑+CO↑
![]()
![]()
![]() ,解得x=8kg。
,解得x=8kg。


 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验的操作、原理和现象,正确的是![]()
A.称取![]() 时,将10g的砝码放在右盘,并将游码移到
时,将10g的砝码放在右盘,并将游码移到![]() 的位置
的位置
B.做钠与水反应的实验时,切取绿豆大小的金属钠,用滤纸吸干其表面的煤油,放入烧杯中,滴入两滴酚酞溶液,再加入少量水,然后观察并记录实验现象
C.向试管中加入5mL溴水、2mL苯和![]() 铁粉,充分振荡后静置,观察试管底部生成褐色油状液滴
铁粉,充分振荡后静置,观察试管底部生成褐色油状液滴
D.为验证盐桥的作用,在两个烧杯中分别盛适量硫酸亚铁铵溶液和稀酸性高锰酸钾溶液,分别插入石墨棒用导线与电流计相连,然后用装有![]() 饱和溶液的琼脂的U型管两端插入两个烧杯中,电流计偏转,一段时间后高锰酸钾溶液褪色
饱和溶液的琼脂的U型管两端插入两个烧杯中,电流计偏转,一段时间后高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列说法正确的是
A.12g![]() 的原子核内中子数为6NA
的原子核内中子数为6NA
B.9.0g葡萄糖和蔗糖的混合物中含碳原子的数目为0.3NA
C.25℃时,1LpH=2的H2C2O4溶液中含H+的数目为0.02NA
D.标准状况下,2.24LCO2与足量Na2O2反应转移的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,氧化铁可以与一氧化碳发生下列反应:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
(1)该反应的平衡常数表达式为K=________。
(2)该温度下,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,10 min后,生成了单质铁11.2 g。则10 min内CO的平均反应速率为________。
(3)该反应达到平衡后,加入Fe粉,平衡________移动;保持恒温恒容通入CO,平衡向________移动。(填“向左”、“向右”或“不”)
(4)表明该反应已达平衡状态的是______________
A.单位时间内生成nmolCO同时生成nmolCO2 B.恒容时混合气体的压强不变
C.混合气体的总质量不变 D.CO2的体积分数不变 E.Fe的浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COCl2 的分解反应为: COCl2(g)=Cl2(g)+CO(g) △H=+108 kJmol-1。某科研小组研究反应体系达到平衡后改变外界条件,各物质的浓度在不同条件下的变化状况,结果如图所示。下列有关判断不正确的是
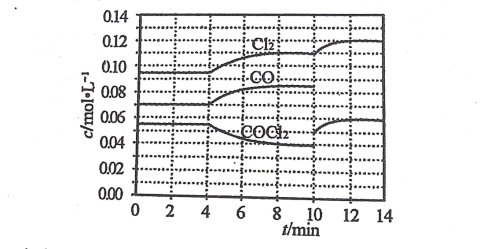
A.第 4min 时,改变的反应条件是升高温度
B.第 6min 时,V 正(COCl2)>V 逆(COCl2)
C.第 8min 时的平衡常数 K=2.34
D.第 10min 到 14min 未标出 COCl2 的浓度变化曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a、b是两根石墨棒。下列叙述正确的是( )
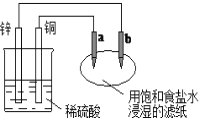
A.a是正极,发生还原反应
B.b是阳极,发生氧化反应
C.往滤纸上滴加酚酞试液,a极附近颜色变红
D.稀硫酸中硫酸根离子的物质的量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和氧化铁的混合物共Xmol,加盐酸后固体全部溶解,共收集到Ymol氢气,且向反应后的溶液中加入KSCN溶液不显红色,则反应后溶液中Fe元素质量为( )
A.56(3X+Y)gB.56(3X-Y)gC.28(3X+Y)gD.28(3X-Y)g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列热化学反应方程式:
(1)1molN2(g)与适量H2(g)起反应生成NH3(g),放出92.2kJ热量:______________。
(2)1molN2(g)与适量O2(g)起反应生成NO(g),吸收68kJ热量:_______________。
(3)1molCu(s)能与一定量的O2(g)起反应生成CuO(s),放出157kJ热量:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法不正确的是( )
A.盖斯定律实质上是能量守恒定律的体现
B.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH= -57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ
C.由C(石墨,s)=C(金刚石,s) ΔH= +1.9kJ/mol,可知石墨比金刚石稳定
D.已知H2(g)+Cl2(g)=2HCl(g) ΔH1= -184.6kJ/mol,则反应HCl(g)=![]() H2(g)+
H2(g)+![]() Cl2(g)的ΔH= -92.3kJ/mol
Cl2(g)的ΔH= -92.3kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com