
磷是重要的非金属元素。
28.1.有关的叙述正确的是 (选填编号)。
a.易溶于CS2 b.易自燃 c.分子中有4个P-P键
P4在过量的热NaOH溶液中会生成PH3气体和NaH2PO2(次磷酸钠),写出该反应的化学方程式 。
由该反应可推知H3PO2为 元酸。用NaH2PO2来验证次磷酸是弱酸,还需要的物质是 。
29.2.NaH2PO2可在酸性条件下与Ni2+作用进行“化学镀镍”(如在木材表面生成一层Ni-P合金),反应中磷元素化合价发生的变化是 (选填编号)。
a.升高 b.降低 c.既升高又降低
30.3.25℃时,HF的Ki = 3.6×10 – 4 ;H3PO4的 Ki1= 7.5×10 -3,Ki2= 6.2×10 -8,Ki3= 2.2×10 -13。
则以下表述错误的是 (选填编号)。
a.0.1mol/L的H3PO4溶液,c(H+)>0.1mol/L
b.NaF和H3PO4反应生成NaH2PO4
c.0.1mol/L的溶液,pH由大到小的顺序是:Na3PO4>Na2HPO4>NaF>NaH2PO4
31.4.Ag3PO4是难溶于水的黄色固体,试用平衡移动的原理解释其溶于稀硝酸的原因 。
28.1.a b;P4+3NaOH+3H2O →3NaH2PO2+PH3↑;一;酚酞溶液。
29.2.c
30.3.a
31.4.由溶解平衡:Ag3PO4(s) 3Ag++ PO43- ,加入稀硝酸后,生成了难电离的物质H3PO4(或H2PO4-),使溶解平衡向右移动(2分)。
3Ag++ PO43- ,加入稀硝酸后,生成了难电离的物质H3PO4(或H2PO4-),使溶解平衡向右移动(2分)。
【解析】试题分析:
28.1.白磷(P4)易溶于CS2、易自燃,分子结构为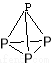 分子中有6个P-P键。
分子中有6个P-P键。
P4在过量的热NaOH溶液中会生成PH3气体和NaH2PO2方程式为:P4+3NaOH+3H2O →3NaH2PO2+PH3↑反应中NaOH溶液过量,说明NaH2PO2为正盐,故H3PO2为一元酸。用NaH2PO2来验证次磷酸是弱酸,可利用盐类水解的原理,测定其溶液的是否呈碱性。
29.2.NaH2PO2中P为+1价。NaH2PO2可在酸性条件下与Ni2+作用进行“化学镀镍”,在木材表面生成一层Ni-P合金,可知Ni、部分P的化学价降低,则另部分P的化学价必然还要升高。
30.3.a.H3PO4为弱电解质,在一级电离的抑制下二级电离与三级电离很微弱,故0.1mol/L的H3PO4溶液,c(H+)<0.1mol/L ,故a错误。
b.由电离常数的大小可知:酸性H3PO4>HF>H2PO4->HPO42-,所以NaF和H3PO4反应生成NaH2PO4与HF,故b正确。
c.由酸性H3PO4>HF>H2PO4->HPO42-,同浓度水解程度顺序为:PO43->HPO42->F->H2PO4-,所以0.1mol/L的溶液,pH由大到小的顺序是:Na3PO4>Na2HPO4>NaF>NaH2PO4,故c正确。
31.4.由溶解平衡:Ag3PO4(s) 3Ag++ PO43- ,加入稀硝酸后,生成了难电离的物质H3PO4(或H2PO4-),使溶解平衡向右移动。
3Ag++ PO43- ,加入稀硝酸后,生成了难电离的物质H3PO4(或H2PO4-),使溶解平衡向右移动。
考点:了解磷元素的单质及化合物的性质及分子结构。了解氧化还原反应的价态变化规律。了解弱电解质在水中的电离平衡。了解难溶电解质的沉淀溶解平衡。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015北京市朝阳区高一上学期期末考试化学试卷(解析版) 题型:填空题
下图为氮及其化合物的类别与化合价对应的关系图。

(1)实验室制取氨气。
① 化学方程式是 。
② 可用向下排空气法收集氨气的原因是 。
③ 用水吸收多余的氨气时,如将导管直接插入水中,
会产生倒吸现象,产生该现象的原因是 。
(2)完成下列能生成NO的化学方程式:
① 体现N元素的还原性:
a. 汽车尾气中产生的NO:N2 + O2  2NO。
2NO。
b. 氨的催化氧化:_________。
② 体现N元素的氧化性:_________。
(3)NO2 易溶于水。将体积为V mL的试管充满NO2后倒扣在水中,见下图。

① NO2溶于水的化学方程式是_________。
② 使试管中NO2完全被水吸收的操作是________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三上学期期中考试化学试卷(解析版) 题型:选择题
含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢(AsH3)在热玻璃管中完全分解成单质砷和氢气。若砷的质量为1.50 mg,则
A.被氧化的砒霜为l.98 mg B.分解产生的氢气为0.672 mL
C.和砒霜反应的锌为3.90 mg D.转移的电子总数为6×10—5NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三上学期期中考试化学试卷(解析版) 题型:选择题
长式周期表共有18个纵行,从左到右排为1—18列,即碱金属为第一列,稀有气体元素为第18列。按这种规定,下列说法正确的是
A.第9列元素中没有非金属元素
B.只有第二列的元素原子最外层电子排布为ns 2
C.第四周期第9列元素是铁元素
D.第10、11列为ds区
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市静安区高三上学期期末教学质量检测化学试卷(解析版) 题型:填空题
铝是第二金属,是地壳中含量最多的金属,用途广泛。
51.1.将某铝土精矿R(Al2O3、Fe2O3)粉末48.8g加入含1mol NaOH的溶液中,发生的反应为:
Al2O3(s)+2NaOH(aq)+ 2H2O(l)→2NaAl(OH)4(aq)
充分反应后,过滤、洗涤、干燥,得到8.0g固体,则该精矿Al2O3的质量分数为 (精确到0.001)。
往滤液中通入CO2,发生的反应为:2NaAl(OH)4 + CO2→2Al(OH)3↓+ Na2CO3+ H2O
若生成0.5 mol Na2CO3,则生成Al(OH)3 mol。
52.2.有反应Al2O3(s)+ Na2CO3(s)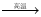 2NaAlO2(s)+ CO2(g)
2NaAlO2(s)+ CO2(g)
2NaAlO2(aq)+ CO2(g) +3H2O→2Al(OH)3↓+ Na2CO3
若以铝土精矿R和Na2CO3为原料,除得到Al2O3外,还得到“赤泥”,其成分为(金属元素均以氧化物形式表示):
Al2O3 | Fe2O3 | Na2O | |
质量分数 | 0.065 | 0.850 | 0.029 |
每1t铝土精矿生产时:
得到的赤泥 t(精确到0.001,下同);
可制得Al2O3得 t;
需要补充购买Na2CO3 kg。
53.3.取a g Al2O3加入溶质的质量分数为b的硫酸溶液中,充分反应后再往溶液加入一定量的(NH4)2SO4,加热、搅拌,冷却后全部溶液正好转化为45.3 g铝铵矾晶体[NH4Al(SO4)2·12H2O,式量:453],则a= ;b= (精确到0.001).
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市静安区高三上学期期末教学质量检测化学试卷(解析版) 题型:选择题
有些物质的制备从化学性质的“强制弱”来看似乎难以进行,但利用勒夏特列原理却取得了成功,以下属于这种情况的是
A.NaBr(s)+H3PO4(浓) NaH2PO4(aq)+ HBr(g)
NaH2PO4(aq)+ HBr(g)
B.6CaO(l)+2Al(l) 3CaOAl2O3(s) +3Ca(g)
3CaOAl2O3(s) +3Ca(g)
C.CaCO3(s) +2HCl(aq) →CaCl2(aq) +H2O (l) +CO2(g)
D.KICl2(aq)+H2S(aq)→KI (aq)+2HCl (aq) +S(s)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市静安区高三上学期期末教学质量检测化学试卷(解析版) 题型:选择题
炼铁的总反应为 Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)+Q kJ ,可能发生了以下过程:
2Fe(s)+3CO2(g)+Q kJ ,可能发生了以下过程:
①3Fe2O3(s)+CO(g) → 2Fe3O4(s)+CO2(g)+Q1 kJ;
②Fe3O4(s)+CO(g) → 3FeO(s)+CO2(g)+Q2 kJ;
③FeO(s)+CO(g) → Fe(s)+CO2(g)+Q3 kJ。
则Q与Q1、Q2、Q2的关系式正确的是
A.Q=Q1+Q2+Q3 B.Q=Q1-Q2-Q3
C.Q=(Q1+2Q2+6Q3)/3 D.Q=(Q1+2Q2+6Q3)/2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4 的混合气体1120 mL (标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀,下列说法不正确的是
A.该合金中铜与镁的物质的量之比是2∶1
B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C.NO2和N2O4 的混合气体中,NO2 的体积分数是80%
D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三1月练习理综化学试卷(解析版) 题型:填空题
[化学——选修2:化学与技术](15分)磷矿石主要以磷酸钙[Ca3(PO4)2 H2O]和磷灰石[Ca5F(PO4)3、Ca5(OH)(PO4)3]等形式存在。图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸。图(b)是热法磷酸生成过程中由磷灰石制单质磷的流程。
H2O]和磷灰石[Ca5F(PO4)3、Ca5(OH)(PO4)3]等形式存在。图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸。图(b)是热法磷酸生成过程中由磷灰石制单质磷的流程。
图(a)
图(b)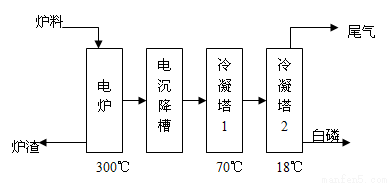
部分物质的相关性质如下:
熔点/℃ | 沸点/℃ | 备注 | |
白磷 | 44 | 280.5 | |
PH3 | -133.8 | -87.8 | 难溶于水,具有还原性 |
SiF4 | -90 | -86 | 易水解 |
回答下列问题:
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的 ℅。
(2)以磷灰石为原料,湿法磷酸过程中Ca3F(PO4)3反应的化学方程式为: 。现有1吨折合含有五氧化二磷约30%的磷灰石,最多可制得85℅的商品磷酸 吨。
(3)如图(b)所示,热法生产磷酸的第一步是将二氧化硅、过量焦炭与磷灰石混合,高温反应生成白磷。炉渣的主要成分是: (填化学式)冷凝塔1的主要沉积物是: 冷凝塔2的主要沉积物是:
(4)尾气中主要含有 ,还含有少量PH3、H2S和HF等,将尾气先通入纯碱溶液,可除去 ;再通入次氯酸钠溶液,可除去 (均填化学式)
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com