
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 完成下列各题.
完成下列各题.


查看答案和解析>>
科目:高中化学 来源: 题型:
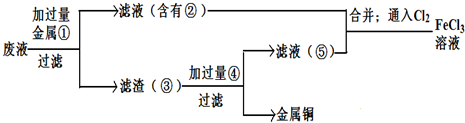
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 化学实验常用仪器和基本操作练习卷(解析版) 题型:实验题
某校化学小组的同学开展了一系列的化学实验活动。

请你参与实验并完成下列问题:
(1)甲同学用图1所示装置,测量锌与硫酸反应速率:把2 g 锌粒放入锥形瓶内,通过分液漏斗加入1 mol·L-1稀硫酸40 mL,收集10 mL气体,通过记录 得到反应速率为x mol·(L·min)-1。实验开始时检查该装置气密性的方法是 。
(2)乙同学用图2装置测定Na2CO3和NaCl的固体混合物中Na2CO3的质量分数:
①甲、乙两试管各有两根导管,用橡胶管连接对应接口后,倒置盛稀硫酸的试管,发生反应,放出气体,则固体混合物和稀硫酸应分别置于 、 仪器中(填仪器编号);
②G管可以用化学实验室里的一种常用仪器来替代,这种仪器是 ;
③仪器甲、乙接口的连接方式如下:A连接 ,B连接 ,C连接 (填写各接口的编号);
④为提高测量的准确性,收集完气体后,丙装置读数前应进行的操作是 。
(3)丙同学与甲同学实验目的相同:用图3装置测定生成的CO2的质量,但该装置存在明显缺陷,从而导致实验误差,请你分析其中使测定结果可能偏大的主要原因 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com